
【题目】以惰性电极电解CuSO4和NaCl的混合溶液,两电极上产生的气体(标准状况下测定)体积如下图所示,下列有关说法正确的是

A.a表示阴极上产生的气体,t1前产生的为Cl2
B.原溶液中CuSO4和NaCl物质的量之比为1:1
C.若t2时溶液的体积为1 L,此时溶液的pH为13
D.若原溶液体积为1 L,则原溶液中SO42的物质的量浓度为0.2 mol/L
【答案】B
【解析】
试题A、以惰性电极电解硫酸铜和氯化钠的混合溶液,阳极发生的电极反应为2Cl--2e-=Cl2↑,4OH--4e-=O2↑+2H2O,阴极发生的电极反应为Cu2++2e-=Cu,2H++2e-=H2↑,由图可知a曲线为阳极气体体积与时间的关系,b曲线为阴极气体与时间的关系,故A选项错误;a曲线为阳极气体体积与时间的关系,且t1前产生的是Cl2,t1-t3产生的是O2,b曲线为阴极气体与时间的关系,且t2-t3产生的是H2,由图可知产生Cl2为112ml,那么n(Cl2)=![]() =0.005mol,则n(NaCl)=0.01mol,n(O2)=
=0.005mol,则n(NaCl)=0.01mol,n(O2)=![]() =0.0025mol,那么共转移电子:0.0025mol×4+0.005mol×2=0.01mol,根据电子守恒可知n(CuSO4)=0.01mol故有n(NaCl):n(CuSO4)=1:1;t2时,4OH--4e-=O2↑+2H2O~4H+,n(H+)=0.0025×4=0.01mol,则c(H+)=0.01mol/L,故pH=2;n(CuSO4)=0.01mol,那么c(SO42-)=0.01mol/L。
=0.0025mol,那么共转移电子:0.0025mol×4+0.005mol×2=0.01mol,根据电子守恒可知n(CuSO4)=0.01mol故有n(NaCl):n(CuSO4)=1:1;t2时,4OH--4e-=O2↑+2H2O~4H+,n(H+)=0.0025×4=0.01mol,则c(H+)=0.01mol/L,故pH=2;n(CuSO4)=0.01mol,那么c(SO42-)=0.01mol/L。


科目:高中化学 来源: 题型:
【题目】Ⅰ.某实验小组对H2O2的分解做了如下探究。下表是该实验小组研究影响H2O2分解速率的因素时记录的一组数据,将质量相同的粉末状和块状的MnO2分别加入盛有15 ml 5%的H2O2溶液的大试管中,并用带火星的木条测试,结果如下:
MnO2 | 触摸试管情况 | 观察结果 | 反应完成所需的时间 |
粉末状 | 很烫 | 剧烈反应,带火星的木条复燃 | 3.5min |
块状 | 微热 | 反应较慢,火星红亮但木条未复燃 | 30min |
(1)写出上述实验中发生反应的化学方程式: 。
(2)实验结果表明,催化剂的催化效果与 有关。
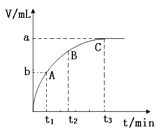
(3)某同学在10 mL H2O2 溶液中加入一定量的二氧化锰,放出气体的体积(标准状况)与反应时间的关系如图所示,则A、B、C三点所表示的反应速率最慢的是 。
Ⅱ.某反应在体积为5L的恒容密闭容器中进行, 在0-3分钟内各物质的量的变化情况如右下图所示(A,B,C均为气体,且A气体有颜色)。
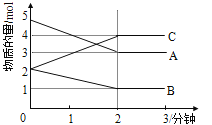
(4)该反应的的化学方程式为 。
(5)反应开始至2分钟时,B的平均反应速率为 。
(6)能说明该反应已达到平衡状态的是 。
a.v(A)= 2v(B) b.容器内各物质的物质的量相等
c.v逆(A)=v正(C) d.容器内气体的颜色保持不变
(7)由图求得平衡时A的转化率为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池。右图为RFC工作原理示意图,下列有关说法正确的是
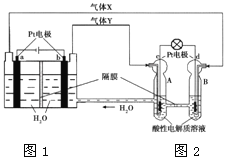
A. 图1把化学能转化为电能,图2把电能转化为化学能,水得到了循环使用
B. 当有0.1 mol电子转移时,a极产生0.56 L O2(标准状况下)
C. c极上发生的电极反应是:O2+ 4H++ 4e-= 2H2O
D. 图2中电子从c极流向d极,提供电能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 1 mol H2O的质量为18g/mol
B. CH4的摩尔质量为16g
C. 3.01×1023个SO2分子的质量为32g
D. 标准状况下,1 mol任何物质体积均为22.4L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Al2H6燃烧热极高,是一种很好的生氢剂,它跟水反应生成H2,球棍模型如图(白球为Al,黑球为H)。下列推测肯定不正确的是
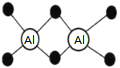
A. 该物质与水反应,属于氧化还原反应
B. Al2H6分子中氢为+1价,铝为﹣3价
C. Al2H6在空气中完全燃烧,产物为氧化铝和水
D. 氢铝化合物可能成为未来的储氢材料和火箭燃料
查看答案和解析>>
科目:高中化学 来源: 题型:
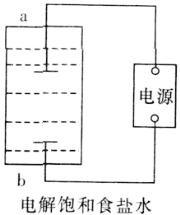
【题目】某兴趣小组模拟氯碱工业生产原理并探究其产品的性质。已知文献记载:
①氯气与冷的氢氧化钠溶液反应生成NaClO;氯气与热的氢氧化钠溶液反应可生成NaClO和NaClO3。②在酸性较弱时KI只能被NaClO氧化,在酸性较强时亦能被NaClO3氧化。
(1)该小组利用如图所示装置制取家用消毒液(主要成分为NaClO),则a为_______(填“阳极”或“阴极”)。生成NaClO的离子方程式为________。
(2)该小组将0.784L(标准状况)Cl2通入50.00mL热的NaOH溶液中,两者恰好完全反应后,稀释到250.0mL。
Ⅰ.取稀释后的溶液25.00mL用醋酸酸化,加入过量KI溶液。用0.2000mol·L-1 Na2S2O3溶液滴定:I2+2S2O32-=2I-+S4O62-,消耗Na2S2O3溶液10.00mL时恰好到达终点。
Ⅱ.将上述滴定后的溶液用盐酸酸化至强酸性,再用上述Na2S2O3溶液滴定到终点,需Na2S2O3溶液30.00mL。
①操作Ⅱ中氯酸钠与碘化钾反应的离子方程式为________。
②反应后的溶液中次氯酸钠和氯酸钠的物质的量之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验现象预测不正确的是
A. 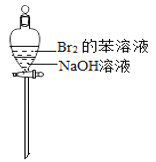 振荡后静置,上层溶液颜色变浅或者褪去
振荡后静置,上层溶液颜色变浅或者褪去
B. 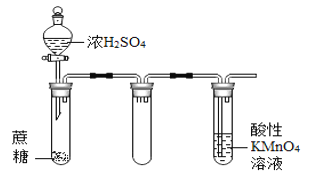 酸性KMnO4溶液中出现气泡,且颜色逐渐褪去
酸性KMnO4溶液中出现气泡,且颜色逐渐褪去
C. 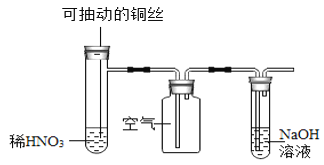 微热稀HNO3片刻,溶液中有气泡产生,广口瓶内变为红棕色
微热稀HNO3片刻,溶液中有气泡产生,广口瓶内变为红棕色
D. 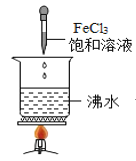 滴入FeCl3饱和溶液后,可形成带电的胶体,该分散系导电能力增强
滴入FeCl3饱和溶液后,可形成带电的胶体,该分散系导电能力增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】进行下列实验,相关说法正确的是
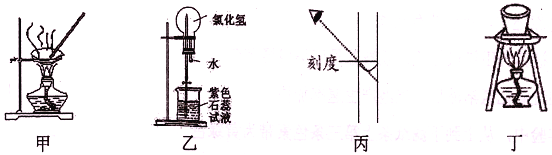
A. 图甲:蒸干NH4Cl饱和溶液制备NH4Cl晶体
B. 图乙:形成美丽的红色喷泉,证明HC1极易溶于水
C. 图丙:配制一定物质的量浓度的NaOH溶液,定容时如图则所配NaOH溶液浓度偏低
D. 图丁:所示装置用于除去碳酸氢钠固体中的少量碳酸钠
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com