
【题目】香料G的一种合成工艺如下图所示。
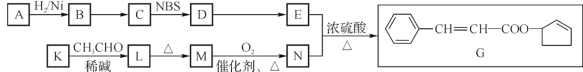
已知:A的分子式为C5H8O,它有两种不同环境的氢原子。
CH3CH2CH=CH2![]() CH3CHBrCH=CH2
CH3CHBrCH=CH2
CH3CHO+CH3CHO![]()
![]()
![]()
![]() CH3CH=CHCHO+H2O
CH3CH=CHCHO+H2O
完成下列填空:
(1)A的结构简式为________________________________。
(2)D中官能团的名称为____________________________。
(3)检验M已完全转化为N的实验操作是___________________________________________。
(4)E与浓硫酸共热可制得H,H可制备一种高分子化合物Q。写出Q的结构简式_________。
(5)写出满足下列条件的L的两种同分异构体的结构简式(不考虑立体异构):__________。
①能发生银镜反应 ②能发生水解反应 ③苯环上的一氯代物有两种
(6)以1-丁醇和NBS为原料可以制备顺丁橡胶(![]() )。请设计合成路线(其他无机原料任选)并用如下方式表示:_____________________________。
)。请设计合成路线(其他无机原料任选)并用如下方式表示:_____________________________。
![]()
【答案】![]() 碳碳双键、溴原子 取少量试样于试管中,滴加稀NaOH至溶液呈碱性,再加入新制Cu(OH)2加热至沸,若没有砖红色沉淀产生,说明M已完全转化为N
碳碳双键、溴原子 取少量试样于试管中,滴加稀NaOH至溶液呈碱性,再加入新制Cu(OH)2加热至沸,若没有砖红色沉淀产生,说明M已完全转化为N 
![]() 、
、![]() 、
、 、
、 CH3CH2CH2CH2OH
CH3CH2CH2CH2OH![]() CH3CH2CH=CH2
CH3CH2CH=CH2![]() CH3CHBrCH=CH2
CH3CHBrCH=CH2![]() CH2=CHCH=CH2
CH2=CHCH=CH2 ![]() -[-CH2CH=CHCH2-]n-
-[-CH2CH=CHCH2-]n-
【解析】
A的分子式为C5H8O,它有两种不同环境的氢原子,说明A具有对称结构,且与氢气发生加成反应,结构中含有2个不饱和结构。统观整个反应流程,K与乙醛在稀碱环境下发生反应,K含有醛基;L有醇羟基和醛基,在加热环境下发生消去反应,醇羟基转为碳碳双键;M在氧气条件下发生氧化反应,醛基氧化为羧基;N和E在浓硫酸环境下生成G,G为酯,即E含有醇羟基和五元环。通过逆推法可知,K为苯甲醛,L为C6H5-CHOH-CH2CHO,M为C6H5-CH=CH-CHO,N为C6H5-CH=CHCOOH,E为![]() ,D为
,D为![]() ,C为
,C为 ![]() ,B为环戊醇,A发生加成反应产生B,A为
,B为环戊醇,A发生加成反应产生B,A为![]() 。
。
(1)A的结构简式为![]() 。
。
(2)D为![]() ,官能团的名称为碳碳双键、溴原子。
,官能团的名称为碳碳双键、溴原子。
(3)检验M已完全转化为N,即检验醛基完全转化为羧基,无醛基结构剩余,实验操作是取少量试样于试管中,滴加稀NaOH至溶液呈碱性,再加入新制Cu(OH)2加热至沸,若没有砖红色沉淀产生,说明M已完全转化为N。
(4)E为![]() ,与浓硫酸共热可制得H,H为
,与浓硫酸共热可制得H,H为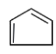 ,H制备一种高分子化合物Q, Q的结构简式为
,H制备一种高分子化合物Q, Q的结构简式为 。
。
(5) L为C6H5-CHOH-CH2CHO,同分异构体①能发生银镜反应,说明含有醛基,②能发生水解反应,说明含有酯基,③苯环上的一氯代物有两种,说明苯环上取代基有两个,且取代基位于对位,或取代基有三个,但其中两个取代基结构一致,整体有机物结构存在对称轴,即同分异构体为![]() 、
、![]() 、
、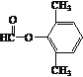 、
、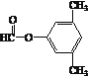 ;
;
(6)以1-丁醇和NBS为原料制备顺丁橡胶(![]() )。根据逆推法原理,顺丁橡胶的单体为1,3-丁二烯,合成路径可以为:CH3CH2CH2CH2OH
)。根据逆推法原理,顺丁橡胶的单体为1,3-丁二烯,合成路径可以为:CH3CH2CH2CH2OH![]() CH3CH2CH=CH2
CH3CH2CH=CH2![]() CH3CHBrCH=CH2
CH3CHBrCH=CH2![]() CH2=CHCH=CH2
CH2=CHCH=CH2 ![]() -[-CH2CH=CHCH2-]n-。
-[-CH2CH=CHCH2-]n-。


科目:高中化学 来源: 题型:
【题目】在一固定容积的密闭容器中,充入2 mol A和1 mol B发生如下反应:2A(g)+B(g) ![]() xC(g),达到平衡后,C的体积分数为w%;若维持容器体积和温度不变,以0.6 mol A、0.3 mol B和1.4 mol C为起始物质,达到平衡后,C的体积分数也为w%,则x的值为
xC(g),达到平衡后,C的体积分数为w%;若维持容器体积和温度不变,以0.6 mol A、0.3 mol B和1.4 mol C为起始物质,达到平衡后,C的体积分数也为w%,则x的值为
A.5 B.4 C.3 D.1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2015年诺贝尔奖获得者屠呦呦提取的抗疟新药青蒿素的结构简式,用键线式表示如图。
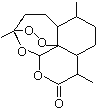
(1)青蒿素的分子式为________________________。
(2)为了引入过氧基![]() ,需要在有机合成中引入羟基,引入羟基的反应类型有_____。(选填编号)
,需要在有机合成中引入羟基,引入羟基的反应类型有_____。(选填编号)
①取代 ②加成 ③消去 ④酯化 ⑤还原
(3)天然香草醛(![]() )可用于合成青蒿素,合成天然香草醛的反应如下:
)可用于合成青蒿素,合成天然香草醛的反应如下:
![]()
(4)步骤①③的作用是_________________________________________________________________________________。
(5)C8H10O3的结构简式:__________________________________________________________。
(6)C与这种天然香草醛互为同分异构体,写出符合下列条件的C的一种结构简式_________________。
①有苯环;②能水解;③能发生银镜反应;④遇FeCl3溶液发生显色反应。
(7)苄基乙醛![]() 是合成青蒿素的中间原料之一,写出由苯甲醛和氯乙烷为原料,制备苄基乙醛的合成路线流程图(无机试剂任用)。____________________
是合成青蒿素的中间原料之一,写出由苯甲醛和氯乙烷为原料,制备苄基乙醛的合成路线流程图(无机试剂任用)。____________________
已知:羰基α-H可发生反应:
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《Inorganic Syntheses》(无机合成)一书中,有一如右图所示的装置,用以制备某种干燥的纯净气体。

该装置中所装的药品正确的是
A.A中装浓硫酸,B中装浓盐酸
B.A中装浓盐酸,B中装浓硫酸
C.A中装氢氧化钠浓溶液,B中装浓氨水
D.A中装浓氨水,B中装氢氧化钠浓溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定CO2的相对分子质量,某实验小组三位同学选用含NaHCO3的样品(质量均为m1g)和其它合理的试剂,进行了以下三个实验。完成下列填空:
甲用重量法确定CO2的质量,装置如下图:
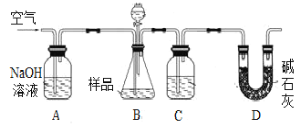
(1)B中反应的化学方程式为____________________________________________________。
(2)实验中持续缓缓通入空气,其作用之一是把生成的CO2全部排入后续装置中,使之完全被吸收;另有作用为___________________________________________________________。
(3)不能提高测定精确度的措施是___________。
a.向B内加入酸之前,排尽装置内的CO2气体
b.向B内滴加酸时不宜过快
c.在B、C之间增添盛有饱和NaHCO3溶液的洗气装置
d.在D后增添盛有碱石灰的干燥管
乙用滴定法确定CO2的物质的量,将样品配制成100mL溶液,从中取出20.00 mL,用c mol·L-1的盐酸滴定(甲基橙作指示剂)。当______________________________________________________时,停止滴定。平行测定三次,有关实验数据记录如下表。m1 g样品产生CO2的物质的量为_____________。
实验编号 | 待测液体积 (mL) | 消耗盐酸体积(mL) | |
初读数 | 末读数 | ||
1 | 20.00 | 0.00 | 25.02 |
2 | 20.00 | 0.20 | 28.80 |
3 | 20.00 | 1.30 | 26.28 |
丙用气体体积法确定CO2的体积,装置如图所示。

(4)为了减小实验误差,量气管中加入的液体X为___________________溶液;
(5)若该装置气密性良好,读数平视,但测得的“CO2体积”数据仍然偏小,其原因可能是____________________________________________________________________________。
(6)确定CO2的相对分子质量,选用___________________(限用“甲”、“乙”、“丙”进行填写)的实验数据为最佳。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳和硅是中学常见元素,其单质及化合物有独特的性质和用途。回答问题:
(1)基态碳原子的电子排布图为___,CO2属于___分子(选填“极性”或“非极性”);
(2)60克SiO2晶体中含有的Si-O键数目为___(用NA表示);
(3)有机物M( )中碳的杂化类型有__,除氢原子之外的其它元素原子的第一电离能由大到小的顺序为__;
)中碳的杂化类型有__,除氢原子之外的其它元素原子的第一电离能由大到小的顺序为__;
(4)碳元素能形成多种单质如金刚石、石墨、C60等,回答下列问题:
(Ⅰ)C60的晶体类型是__晶体。
(Ⅱ)石墨是一种混合晶型,结构中具有的作用力有___。
a.共价键 b.分子间作用力 c.氢键 d.金属键 e.离子键
(Ⅲ)金刚石晶胞结构如图所示,假设金刚石晶胞的边长为a cm,阿伏伽德罗常数为NA,则金刚石的密度可以表示为___g/cm3。
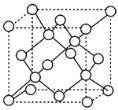
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组拟探究H+浓度对MnO2与H2O2反应速率的影响。现取等量MnO2和下表有关物质,在相同温度下进行4组实验,分别记录收集20.0mL氧气所需时间。
实验编号 | Ⅰ | Ⅱ | Ⅲ | Ⅳ |
10%H2O2的体积/mL | 5.0 | 5.0 | V1 | V2 |
20%硫酸的体积/mL | 0 | 0.5 | 1.0 | V3 |
水的体积/mL | 15 | 14.5 | V4 | 13.5 |
所需时间t/s | t1 | t2 | t3 | t4 |
已知酸性条件下时:MnO2+H2O2+2H+=Mn2++O2↑+2H2O
(1)实验Ⅰ发生反应的化学方程式为__,实验Ⅱ中MnO2的作用是__。
(2)上表中V1=__mL,V3=___mL。
(3)若实验测得t2>t3>t4,则可得出的实验结论是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是侯氏制碱法在实验室进行模拟实验的生产流程示意图,则下列叙述正确的是( )
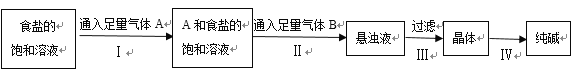
A.第Ⅱ步的离子方程式为Na++NH3+H2O+CO2→NaHCO3↓+NH4+
B.第Ⅲ步得到的晶体是Na2CO310H2O
C.A气体是CO2,B气体是NH3
D.第Ⅳ步操作的过程主要有溶解、蒸发、结晶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我们学过的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡等,且均符合勒夏特列原理。
一定温度下,向1 L密闭容器中加入1 mol HI(g),发生反应。有关物质的量随时间的变化如图所示。
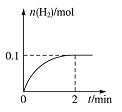
(1)0~2 min内的平均反应速率![]() _____
_____![]() 平衡常数表达式为
平衡常数表达式为![]() _________________。
_________________。
(2)相同温度下,若开始加入![]() 的物质的量是原来的2倍,则____是原来的2倍。
的物质的量是原来的2倍,则____是原来的2倍。
A.平衡常数 B.![]() 的平衡浓度
的平衡浓度
C.达到平衡的时间 D.平衡时体系压强
(3)下列措施肯定能使平衡向逆反应方向移动的是的_____。
A.充入少量氨气 B.降温至0℃ C.充入少量硫化氢 D.加压
(4)常温下,将![]() 的盐酸a L分别与下列三种溶液混合,结果溶液均呈中性。
的盐酸a L分别与下列三种溶液混合,结果溶液均呈中性。
① 浓度为![]() 的氨水b L;②
的氨水b L;② ![]() 的氨水c L;③
的氨水c L;③ ![]() 的氢氧化钡溶液d L。则a、b、c、d之间由大到小的关系是:_________________。
的氢氧化钡溶液d L。则a、b、c、d之间由大到小的关系是:_________________。
(5)常温下,取![]() 的盐酸和醋酸溶液各100 mL,向其中分别加入量的Zn粒,反应过程中两溶液的pH变化如图所示。则图中表示醋酸溶液中pH变化曲线的是___(填“A”或“B”);设盐酸中加入的Zn质量为
的盐酸和醋酸溶液各100 mL,向其中分别加入量的Zn粒,反应过程中两溶液的pH变化如图所示。则图中表示醋酸溶液中pH变化曲线的是___(填“A”或“B”);设盐酸中加入的Zn质量为![]() ,醋酸溶液中加入的Zn质量为
,醋酸溶液中加入的Zn质量为![]() ,则
,则![]() ___
___![]() 。(选填“<”、“=”、“>”)
。(选填“<”、“=”、“>”)
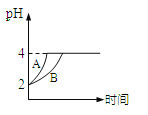
(6)某温度时,在25mL 0.1mol/L NaOH溶液中逐滴加入0.2mol/L CH3COOH溶液,曲线如下图所示,有关粒子浓度关系的比较正确的是____。

A.在A、B间任一点,溶液中一定都有![]()
B.在B点,![]() ,且有
,且有![]()
C.在C点:![]()
D.在D点:![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com