
【题目】下列说法中正确的是
A. 凡是放热反应都是自发的,吸热反应都是非自发的
B. 自发反应一定是熵增大,非自发反应一定是熵减小或不变
C. 自发反应在恰当条件下才能实现
D. 自发反应在任何条件下都能实现
科目:高中化学 来源: 题型:
【题目】醋酸溶液中存在电离平衡CH3COOH ![]() H++CH3COO-,下列叙述不正确的是( )
H++CH3COO-,下列叙述不正确的是( )
A.醋酸溶液中离子浓度的关系满足:c(H+)=c(OH—)+c(CH3COO—)
B.0.10mol/L的CH3COOH溶液中加水稀释,溶液中c(OH—)减小
C.CH3COOH溶液中加少量的CH3COONa固体,平衡逆向移动
D.常温下pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合后,溶液的pH<7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族.将等物质的量的X、Y的单质充入一密闭容器中,在适当催化剂和恒温、恒压条件下发生可逆反应。下列说法正确的是
A. 达到化学平衡时,正反应速率与逆反应速率不相等
B. 反应过程中,Y的单质的体积分数始终为50%
C. 达到化学平衡时,X、Y的两种单质在混合气体中的物质的量之比为1:1
D. 达到化学平衡的过程中,混合气体平均相对分子质量逐渐减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某无色酸性溶液中能大量共存的一组离子是
A.Na+、K+、CO32-、NO3- B.K+、MnO4-、NH4+、NO3-
C.NH4+、SO42-、Al3+、NO3- D.Na+、Ca2+、NO3-、CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素A、B、C、D、E、F、G、H、I、J在周期表中的位置如下:

按要求回答下列问题。
(1)上表元素中,形成气态氢化物最稳定的是____元素(填元素符号)。
(2)32Ge与B同族,32Ge的最高价的氧化物与氢氧化钠反应的化学方程式为
_______________________________________________________________。
(3)等电子的D、F、G、H四种元素形成的离子,离子半径由大到小的顺序是(填离子符号)
_____> > > 。
(4)D、I元素形成的氢化物中,沸点较高的是_____________,理由__________________。
(5)34Se非金属性比D______(填“强”或“弱”),从原子结构的角度解释其原因为______________。
(6)用电子式表示E、G形成化合物的过程_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜及其化合物在工农业生产及日常生活中应用非常广泛。回答下列问题:
(1)纳米级Cu2O由于具有优良的催化性能而受到关注,制取Cu2O的两种方法如下表所示。
方法I | 用炭粉在高温条件下还原CuO生成Cu2O和CO2 |
方法II | 用肼(N2H4)还原新制Cu(OH)2 |
① 方法I中还原剂与氧化剂的物质的量之比为________。
② 方法II发生反应的化学方程式为______________。
(2)氢化亚铜是一种红色同体,可由下列反应制备:
4CuSO4+3H3PO2+6H2O=4CuH↓+4H2SO4+3H3PO4
该反应中每转移3 mol电子,生成CuH的物质的量为___________mol。
(3)氯化铜溶液中各种含铜微粒的分布分数(平衡时某微粒的浓度占各微粒浓度之和的分数)与c(C1-)之间的关系如图所示。

① 当c(C1-)= 9 mol/L时,溶液中3种主要含铜微粒浓度的大小关系为__________。
② 在c(C1-)= l mol /L的氯化铜溶液中,加人AgNO3溶液,CuCl+转化为Cu2+的离子方程式为____________。
(4)已知:Cu(OH)2是二元弱碱,25℃时Ksp[Cu(OH)2]=2.0×10-20。则此温度下在铜盐溶液中Cu2+发生水解反应的平衡常数为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,下列离子组在给定条件下一定能大量共存的是
A. pH=1的溶液中:K+、Na+、NO3-、CH3COO-
B. Na2S溶液中:K+、Na+、NO3-、Ag+
C. KCl溶液中:Na+、Fe3+、SO42-、SCN-
D. c(OH-)=1×10-13mol·L-1的溶液中:K+、Mg2+、Cl-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜(CuCl)广泛应用于化工、印染、电镀等行业。CuCl难溶于醇和水,在潮湿空气中易水解氧筑化,且在氯离子浓度较大的体系中存在CuCl+Cl-=[CuCl2]-。工业上用低品铜矿(主要含CuS、Cu2S、FeO等)制备CuCl的一种工艺流程如下:
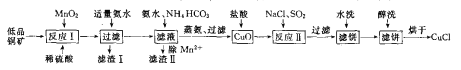
回答下面问题:
(1)反应I中被氧化的元素有_________。(填元素符号)
(2)滤渣II的成分主要为MnCO3,写出除Mn2+的离于方程式_________。
(3)写出反应II中发生反应的离子方程式_________。
(4)在进行反应II时,通入的SO2一般都要适当过量,目的是_________。
(5)滤饼进行醇洗的目的是_________。
(6)在进行反应II时,当氯化钠用量增加到一定程度后氯化亚铜的沉淀率减小,原因是_________。
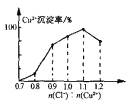
(7)Cu2+的沉淀率是指转化为CuCl的n(Cu2+)占总的n(Cu2+)的百分比。在一定条件下Cu2+沉淀率与沉淀前的Cl-、Cu2+的物质的量之比[n(Cl-): n(Cu2+)]的关系如下图所示。CuCl+Cl-![]() [CuCl2]-的平衡常数K=6.5×10-2,则该条件下Cu2+的最大沉淀率为_________。(保留两位小数)。
[CuCl2]-的平衡常数K=6.5×10-2,则该条件下Cu2+的最大沉淀率为_________。(保留两位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 20℃时,AgCl固体在等物质的量浓度的NaCl、MgCl2溶液中的溶度积相同
B. 浓度为0.2mol/L的KHCO3溶液:c(H2CO3)>c(CO32-)
C. a mol/LHCN溶液与b mol/L NaOH溶液等体积混合后,所得溶液中c(Na+)>c(CN-),则a一定大于b
D. 常温下,在0.1mol/L的NaOH溶液中,由水电离出的c(H+)<![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com