
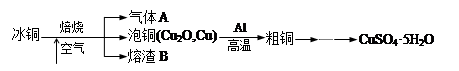
|

 6Cu+ Al2O3 (1分)
6Cu+ Al2O3 (1分) 6Cu+ Al2O3。
6Cu+ Al2O3。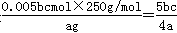 。
。

科目:高中化学 来源:不详 题型:单选题
A.某溶液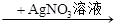 生成白色沉淀,说明原溶液中有Cl- 生成白色沉淀,说明原溶液中有Cl- |
B.某溶液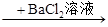 生成白色沉淀,说明原溶液中有SO42- 生成白色沉淀,说明原溶液中有SO42- |
C.某溶液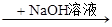 生成红褐色沉淀,说明原溶液中有Fe3+ 生成红褐色沉淀,说明原溶液中有Fe3+ |
D.某溶液 生成无色气体,说明原溶液中有CO32- 生成无色气体,说明原溶液中有CO32- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
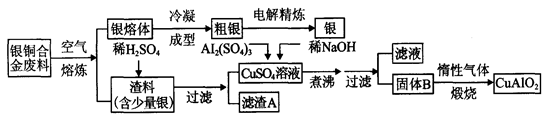
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 实验步骤(不要求写出具体操作过程) | 预期实验现象和结论 |
| 取少量黑色固体, | |

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.向其中放入过量镁条,反应完毕后取出 |
| B.蒸馏 |
| C.加入能氧化I2的KMnO4,再分液 |
| D.通入氯气 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.沉淀X的成分是SiO2 |
| B.将蛇纹石试样直接溶于过量的NaOH溶液后过滤,可得到红色颜料Fe2O3 |
| C.在溶液Y中加入过量的NaOH溶液,过滤得到的沉淀的主要成分是Fe(OH)3和Mg(OH)2 |
| D.溶液Y中的阳离子主要是Mg2+.Al3+.Fe3+.H+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.除去乙醇中混有的乙酸:加入氢氧化钠溶液分液 |
| B.除去混在CO2中的SO2:将气体通过饱和碳酸钠溶液洗气 |
| C.除去KCl溶液中的K2CO3:加入过量BaCl2溶液后过滤 |
| D.除去混在CO2中的CO:将气体通过装有灼热氧化铜的加热管 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
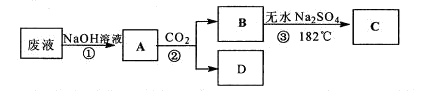
| 实验操作 | 预期现象 | 现象解释 |
| 步骤1:取少量C放入a试管,加入少量蒸馏水,振荡。 | | |
| 步骤:取少量C的稀溶液分装b、c两支试管,往b试管 | 产生白色沉淀 | |
| 步骤3:往c试管 | | C与加入的试剂发生显色反应。 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com