
【题目】【合肥市2017届第三次模拟考试】对烟道气中的SO2进行回收再利用具有较高的社会价值和经济价值。
Ⅰ.CO还原法
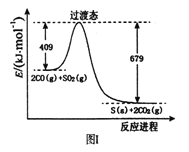
(1)一定条件下,由SO2和CO反应生成S和CO2的能量变化如右图I所示,每生成16gS(s) ,该反应_______(填“放出”或“吸收”)的热量为_________。
(2)在绝热恒容的密闭容器中,进行反应:
2CO(g)+SO2(g) ![]() S(s)+2CO2(g),该反应的平衡常数表达式为_______。对此反应下列说法正确的是__________
S(s)+2CO2(g),该反应的平衡常数表达式为_______。对此反应下列说法正确的是__________
A.若混合气体密度保持不变,则已达平衡状态
B.反应开始到平衡时,容器内气体的压强保持不变
C.达平衡后若再充人一定量CO2,平衡常数保持不变
D.分离出S,正、逆反应速率均保持不变
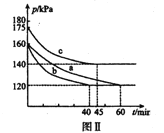
(3)向2L恒温恒容密闭容器中通入2molCO和lmolSO2,分别进行a、b、c三组实验。在不同条件下发生反应:2CO(g)+SO2(g)![]() S(s)+2CO2,反应体系总压强随时间的变化曲线如下图Ⅱ所示,则三组实验温度的关系是a ______b ______c (填“> ”、“< ”、或“=”) ;实验a从反应开始至平衡时,反应速率v(SO2)=____________。
S(s)+2CO2,反应体系总压强随时间的变化曲线如下图Ⅱ所示,则三组实验温度的关系是a ______b ______c (填“> ”、“< ”、或“=”) ;实验a从反应开始至平衡时,反应速率v(SO2)=____________。
Ⅱ.Na2SO3溶液吸收法
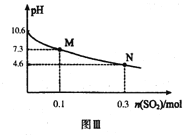
常温下,用300mL1.0mol·L-1,Na2SO3溶液吸收SO2的过程中,溶液pH随吸收SO2物质的量的变化曲线如上图Ⅲ所示。
(4)1.0mol·L-1 Na2SO3溶液中离子浓度由大到小的顺序为_________
(5)若用等体积、等物质的量浓度的下列溶液分别吸收SO2,则理论上吸收量最多的是____
A.NH3·H2O B.Na2S C.Na2CO3 D.FeCl3
(6)常温下,H2SO3的二级电离平衡常数Ka2的数值为_________。
【答案】放出 135KJ K=c2(CO2)/[c2(CO2)·c(SO2)] A、D = <
6.25×10-3mol/(L·min) c(Na+)>c(SO32-)>c(OH-)>c(HSO4-)>c(H+) B 10-7.3
【解析】Ⅰ.CO还原法
(1)从图示可知,反应物能量高生成物能量低,所以该反应为放热反应,2CO(g)+SO2(g) ![]() S(s)+2CO2(g),反应热为△H=(409-679)kJ/mol=―270kJ/mol,故生成16gS放出的热量为16g/32g·mol-1×270kJ/mol=135kJ;(2)2CO(g)+SO2(g)
S(s)+2CO2(g),反应热为△H=(409-679)kJ/mol=―270kJ/mol,故生成16gS放出的热量为16g/32g·mol-1×270kJ/mol=135kJ;(2)2CO(g)+SO2(g) ![]() S(s)+2CO2(g),该反应的平衡常数表达式为 K=c2(CO2)/[c2(CO2)·c(SO2)],注意硫为固体;对此反应下列说法正确的是AD。A.若混合气体密度保持不变,因为S是固体,只要平衡发生移动,组成就要发生变化,则已达平衡状态,故A正确;B.2CO(g)+SO2(g)
S(s)+2CO2(g),该反应的平衡常数表达式为 K=c2(CO2)/[c2(CO2)·c(SO2)],注意硫为固体;对此反应下列说法正确的是AD。A.若混合气体密度保持不变,因为S是固体,只要平衡发生移动,组成就要发生变化,则已达平衡状态,故A正确;B.2CO(g)+SO2(g)![]() S(s)+2CO2(g)是气体体积减小的反应,反应开始到平衡时,容器内气体的压强发生改变,故B错误;C.达平衡后若再充人一定量CO2,平衡逆向移动,要吸收能量,在绝热恒容的密闭容器中,温度要降低,平衡常数减小,,故C错误;D.分离出S,对生成物浓度没有影响,正、逆反应速率均保持不变,故D错误。故选AD。(3)a和b反应起始压强相同,平衡时压强相同,b快说明加的是催化剂,如温度不同,最后平衡时压强不同,故温度a=b;升高温度,平衡逆向移动,压强增大,故b的温度低于c,故三组实验温度的关系是a=b <c ;由图a反应前后压强之比=反应前后物质的量之比,
S(s)+2CO2(g)是气体体积减小的反应,反应开始到平衡时,容器内气体的压强发生改变,故B错误;C.达平衡后若再充人一定量CO2,平衡逆向移动,要吸收能量,在绝热恒容的密闭容器中,温度要降低,平衡常数减小,,故C错误;D.分离出S,对生成物浓度没有影响,正、逆反应速率均保持不变,故D错误。故选AD。(3)a和b反应起始压强相同,平衡时压强相同,b快说明加的是催化剂,如温度不同,最后平衡时压强不同,故温度a=b;升高温度,平衡逆向移动,压强增大,故b的温度低于c,故三组实验温度的关系是a=b <c ;由图a反应前后压强之比=反应前后物质的量之比, ![]() ,反应后物质的量为n=2.25mol,每有1molSO2参加反应,反应气体体积减少1体积,所以参加反应的SO2 为3mol―2.25mol=0.75mol,v(SO2)=
,反应后物质的量为n=2.25mol,每有1molSO2参加反应,反应气体体积减少1体积,所以参加反应的SO2 为3mol―2.25mol=0.75mol,v(SO2)=![]() 。
。
Ⅱ、(4)Na2SO3水溶液中,有Na+,SO32-,HSO3-,OH-,H+,首先,根据物料守恒c(Na+)=2c(SO32-)+2c(HSO3-)+2c(H2SO3)(溶液中Na元素是S元素的2倍),可知Na+浓度是最大的,SO32-的水SO32-+H2O![]() HSO3-+OH-,水解是微弱的,所以SO32-的浓度大于HSO3-和OH-HSO3-进一步水HSO3-+H2O
HSO3-+OH-,水解是微弱的,所以SO32-的浓度大于HSO3-和OH-HSO3-进一步水HSO3-+H2O![]() H2SO3+OH-,虽然这一步水解极其微弱,但毕竟是存在,这将导致OH-的浓度大于HSO3-(另外还有水的电解),1.0mol·L-1 Na2SO3溶液中离子浓度由大到小的顺序为 c(Na+)>c(SO32-)>c(OH-)>c(HSO4-)>c(H+) 。(5)若用等体积、等物质的量浓度的下列溶液(设溶质为1mol)分别吸收SO2,A、2NH3·H2O+SO2=(NH4)2SO3+H2O,吸收 0.5mol;B、2Na2S+5SO2+2H2O=4NaHSO3+3S ,1molNa2S吸收2.5molSO2;C、Na2CO3+2SO2+H2O=2NaHSO3+CO2 1molNa2CO3吸收2molSO2;D、2Fe3++SO2+2H2O
H2SO3+OH-,虽然这一步水解极其微弱,但毕竟是存在,这将导致OH-的浓度大于HSO3-(另外还有水的电解),1.0mol·L-1 Na2SO3溶液中离子浓度由大到小的顺序为 c(Na+)>c(SO32-)>c(OH-)>c(HSO4-)>c(H+) 。(5)若用等体积、等物质的量浓度的下列溶液(设溶质为1mol)分别吸收SO2,A、2NH3·H2O+SO2=(NH4)2SO3+H2O,吸收 0.5mol;B、2Na2S+5SO2+2H2O=4NaHSO3+3S ,1molNa2S吸收2.5molSO2;C、Na2CO3+2SO2+H2O=2NaHSO3+CO2 1molNa2CO3吸收2molSO2;D、2Fe3++SO2+2H2O![]() 2Fe2++4H++SO42―,1molFeCl3吸收0.5molSO2;故选B;(6)常温下,H2SO3的二级电离平衡常数Ka2的数值为
2Fe2++4H++SO42―,1molFeCl3吸收0.5molSO2;故选B;(6)常温下,H2SO3的二级电离平衡常数Ka2的数值为 。
。
Na2SO3+H2O+SO2=2NaHSO3,当通入0.1molSO2时


 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:
【题目】【衡阳市2017届下学期第三次联考】Na2S2O5常用作纺织业棉麻脱氯剂;酸化时可放出SO2气体。其制备工艺流程如下:

(1)Na2S2O5的名称为_______________(选填“焦硫酸钠”或“焦亚硫酸钠”)。
(2)“反应I ”中应先通入的气体是_____,反应后析出的固体产物是____________。
(3)“反应II”的化学方程式为_________________________。
(4)若反应条件或用量等控制不当,则所得的Na2S2O5产品中往往含有杂质。
①若产品中含有杂质Na2SO3,其具体原因可能是______________(任答一条即可);
②若检验产品中含有杂质Na2SO3,下列试剂的使用顺序依次为_________(填编号)。
A.稀硫酸 B.澄淸石灰水 C.品红溶液 D.酸性KMnO4溶液
(5)Na2S2O3也可用作棉麻的脱氯剂。
①Na2S2O5溶液与Cl2反应的离子方程式为____________________;
②Na2S2O5与Na2S2O3脱氯等效时,消耗二者的质量之比为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【贵阳市第一中学2017届下学期第六次适应性考试】U、V、W、X、Y、Z是原子序数依次增大的短周期元素。已知:
①WU4++XU-==WU3+U2X,各种反应物和生成物的电子总数都与Y+相等;
②Z的单质在X2中燃烧的产物可使品红溶液褪色;
③V的单质在X2中燃烧可生成VX和VX2两种气体;
④Y的单质是一种金属,该金属与X2反应可生成Y2X和Y2X2两种固体。
请回答下列问题:
(1)写出Y2X2与水反应的化学方程式:________________。
(2)V、W、X形成的10电子氢化物中,沸点最高的是__________(写化学式)。
(3)U2X2与FeSO4按物质的量之比1:2溶于稀硫酸中,反应的离子方程式为__________。
(4)常温下,向pH=11的Y2VX3溶液中加入过量石灰乳,过滤后所得溶液pH=13,则反应前的溶液中与反应后的滤液中水电离出的c(OH-)的比值是_________。
(5)已知由U、W两种元素组成的共价化合物联氨的球棍模型如图所示,则联氨分子的电子式为_______。联氨为二元弱碱,在水中的电离方程式与氨相似,联氨第一步电离反应的平衡常数值为_______(已知:N2H4+H+==N2H5+的K=8.7×107;KW=1.0×10-14)。联氨与过量硫酸形成的酸式盐的化学式为_______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与社会、生产、生活紧切相关。下列说法正确的是( )
A.无水乙醇常用于杀菌消毒
B.乙烯常用作果实催熟剂
C.石油干馏可得到石油气、汽油、煤油、柴油等
D.氟利昂化学性质稳定,有毒,不易燃烧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】离子方程式:CO![]() +2H+===CO2↑+H2O表示( )
+2H+===CO2↑+H2O表示( )
A. 碳酸盐和盐酸之间的反应
B. 一切碳酸盐与一切酸之间的反应
C. 可溶性碳酸盐与酸之间的反应
D. 可溶性碳酸盐与强酸之间的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烧杯中盛有100 mL 1 mol/L的NaHSO4溶液,向其中逐滴滴加1 mol/L的Ba(OH)2溶液,烧杯中某些物质(或微粒)的物质的量的变化曲线如图。下列说法中正确的是( )

A. 曲线a表示Na+的物质的量的变化
B. 曲线c表示Ba2+的物质的量的变化
C. 加入50 mL Ba(OH)2溶液时反应的离子方程式为Ba2++2OH-+2H++ ![]() BaSO4↓+2H2O
BaSO4↓+2H2O
D. 加入Ba(OH)2溶液体积大于50 mL后,反应的离子方程式为OH-+H+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲除去下列物质中混入的少量杂质(括号内物质为杂质),不能达到目的的是
A.乙酸乙酯(乙酸):加饱和Na2CO3 溶液,充分振荡静置后,分液
B.乙醇(水):加入新制生石灰,蒸馏
C.乙酸(乙醇):加入金属钠,蒸馏
D.苯(液溴):加入NaOH溶液,分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【湖南省2017年考前演练卷(三)】利用下列实验装置进行相应的实验,不能达到实验目的的是

A.利用图甲装置,可快速制取氨气
B.利用图乙装置,用饱和碳酸钠溶液分离CH3CH2OH和CH3COOC2H5混合液
C.利用图丙装置,可制取乙烯并验证其易被酸性KMnO4溶液氧化
D.利用图丁装置,可说明浓H2SO4具有脱水性、强氧化性,SO2具有漂白性、还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现将31.8gNa2CO3固体溶于水配成体积为1L的溶液,回答下列问题:
(1)该溶液中含有CO32-的数目是______________,Na+的浓度是___________mol/L
(2)现有某浓度的浓盐酸,该盐酸的密度d=1.2g/cm3,质量分数w = 36.5%,计算该盐酸的物质的量浓度是__mol/L。
(3)欲将题干中的Na2CO3完全反应生成CO2气体,则至少需要(2)中的盐酸_________mL,生成的CO2气体的体积是_________mL (标况下)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com