
【题目】溶液、浊液和胶体这三种分散系的根本区别是( )
A.丁达尔效应
B.是否能透过半透膜
C.是否均一、透明、稳定
D.分散质粒子大小
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:
【题目】诺卜醇可用于调制木香型化妆品及皂用香精。一种制备方法如图所示,下列说法正确的是
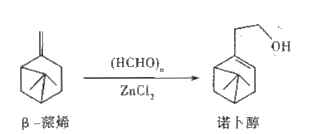
A. 可用溴的CCl4溶液区别β-蒎烯与诺卜醇
B. β-蒎烯的饱和碳原子上的一氯代物最多有7种
C. β-蒎烯和诺卜醇分子中都有一个由5个碳原子构成的四面体
D. 可用乙酸检验β-蒎烯是否含有诺卜醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示的甲、乙、丙三种晶体:
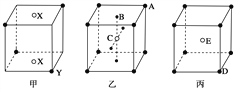
试写出:
(1)甲晶体的化学式(X为阳离子)为________。
(2)乙晶体中A、B、C三种粒子的个数比是________。
(3)丙晶体中每个D周围结合E的个数是________个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)计算下列分子或离子中带点“·”原子的价电子对数。
①CCl4________;②BeCl2________;③BCl3________;④PCl3________。
(2)计算下列微粒中带点“·”原子的孤电子对数。
①H2S ________;②PCl5________;③BF3________;④NH3________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】辉铜矿石主要含有硫化亚铜(Cu2S)及少量脉石(SiO2)。一种以辉铜矿石为原料制备硝酸铜的工艺流程如下所示:
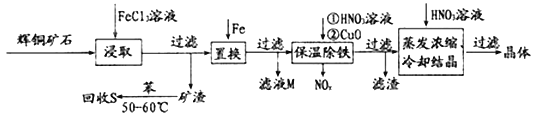
(1)“浸取”时,为了提高浸取速率可采取的措施有___________________________(任写一点)。写出“浸取”过程中Cu2S溶解时发生反应的离子方程式:_____________________________________。
(2)“保温除铁”过程中,加入CuO的目的是_________________________________________;“蒸发浓缩、冷却结晶”过程中,加入HNO3调节溶液的pH,其理由是____________________。
(3)气体NOx与氧气混合后通入水中能生成流程中可循环利用的一种物质,该反应的化学方程式为________________________________。向“滤液M”中加入(或通入)_____ (填字母),可得到另一种可循环利用的物质。
a.铁 b.氯气 c.高锰酸钾
(4)“回收S”过程中温度控制在50 ~60℃之间,不宜过高或过低的原因是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的前三周期主族和0族元素区,表中虚线处为ⅡA、ⅢA族的连接处,请用相应的化学用语回答下列问题:

(1)写出仅由e形成的两种带有相同电荷数的阴离子的符号________、________。
(2)d的元素名称为________,其双原子分子的电子式为________。
(3)图I是表示第三周期8种元素单质的熔点(℃)条形图,已知条形“1”代表Ar,则其中条形“8”代表的是________(填化学式)晶体,1 mol该晶体中含有________mol化学键。

(4)b、c、d、e、f的氢化物的沸点(℃)直角坐标图(图Ⅱ)中序列“5”对应的氢化物的名称是__________,空间构型为__________;序列“2”对应的氢化物的结构式是__________,属于________(填“极性”或“非极性”)分子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某纯碱样品中含有少量氯化钠杂质,现用下图所示装置来测定纯碱样品中碳酸钠的质量分数(铁架台、铁夹等在图中均已略去)。实验步骤如下:

①按图连接装置,并检查气密性;
②准确称得盛有碱石灰(固体氢氧化钠和生石灰的混合物)的干燥管 D 的质量为 86.4g;
③准确称得 6g 纯碱样品放入容器 b 中;
④打开分液漏斗 a 的旋塞,缓缓滴入稀硫酸,至不再产生气泡为止;
⑤打开弹簧夹,往试管 A 中缓缓鼓入空气数分钟,然后称得干燥管 D 的总质量为 88.6g。 试回答:
(1)鼓入空气的目的是_____,装置 A 中试剂 X 应选用_____;
(2)若④、⑤两步的实验操作太快,则会导致测定结果_____(填“偏大”或“偏小”)
(3)若没有 C 装置,则会导致测定结果_____(填“偏大”或“偏小”)
(4)根据实验中测得的有关数据,计算出纯碱样品 Na2CO3 的质量分数为_____;
(5)本实验设计是否存在问题_____(填“是”或“否”),若存在,改进措施为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向Na2CO3溶液中滴入盐酸,混合溶液的pH与离子浓度变化的关系如图所示。
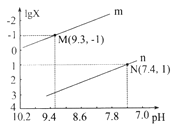
己知:lgX=lg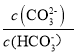 或lg
或lg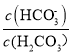 ,下列叙述正确的是
,下列叙述正确的是
A. 曲线m表示pH与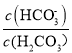 的变化关系
的变化关系
B. 当溶液呈中性时,c(Na+)= ![]() +2
+2![]()
C. Ka1(H2CO3)=1.0×10-6.4
D. 25℃时,CO32-+H2O![]()
![]() +OH-的平衡常数为1.0×10-7.6
+OH-的平衡常数为1.0×10-7.6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1) 如图所示为二维平面晶体示意图,所表示的化学式为AX3的是____。
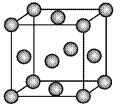
(2)图为一个金属铜的晶胞,请完成以下各题。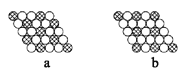
①该晶胞“实际”拥有的铜原子数是____个。
②该晶胞称为____。(填序号)
A.六方晶胞 B.体心立方晶胞 C.面心立方晶胞
③此晶胞立方体的边长为a cm,Cu的相对原子质量为64,金属铜的密度为ρ g·cm-3,则阿伏加德罗常数为________________________(用a、ρ表示,列出表达式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com