
【题目】目前,我国是最大的钢铁生产国,钢铁是国民经济的基础产业,铁及其化合物的应用也越来越广泛。回答下列问题:
(1)画出铁的原子结构示意图:______________。
(2)工业炼铁时常用CO还原铁矿粉,已知:
① Fe2O3(s) + 3CO(g)=2Fe(s)+ 3CO2(g) △H=-24.8 kJ/mol
② Fe3O4(S)+CO(g)=-3FeO(g)+CO2(g) △H= +19.4 kJ/mol
③ FeO(s)+CO(g)=Fe(s)+CO2(g) △H= -11.0 kJ/mol
则反应3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)的△H= ________。
(3)Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) 反应温度与K的关系如右表:
反应温度/℃ | 1000 | 1150 | 1300 |
平衡常数K | 64 | 50.7 | 42.9 |
恒温1000℃在体积为10L的恒容密闭容器中加入0.1molFe2O3和0.1molCO,气体混合物中CO2的体积分数φ(CO2)随时间t的变化关系如图所示。

①前 8minCO 的反应速率为_______;平衡时a=____。
②若再向平衡混合物中加入0.01molCO 和0.02molCO2,平衡_______移动;若要使平衡混合气中CO2的体积分数增大,下列措施可行的是_______(填标号)。
A.增大Fe2O3用量 B.增大压强 C.降低温度 D.向容器中再充入少量CO
(4)纳米级的Fe3O4在催化剂、造影成像、药物载体、靶向给药等领域都有很好的应用前景,工业生产中常用“共沉淀法”来制备。将FeCl2和FeCl3按一定比例配成混合溶液,用NaOH溶液作为沉淀剂,在特定条件下即可制得纳米级的Fe3O4,反应的离子方程式是_____,在实际生产中Fe2+和Fe3+反应用量比常是2:3,甚至1:1,为什么?________。
(5)纳米铁粉可用于除去废水中的NO3-,反应的离子方程式为:4Fe+ NO3-+ 10H+=4Fe2++NH4++3H2O。研究发现,若pH偏低将会导致NO3-的去除率下降,其原因是________;若加入少量Cu2+,废水中NO3-的去除速率大大加快,可能的原因是_____________。
【答案】 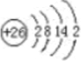 -47.2 kJ/mol 10-3 mol·L-1·min-1 80%或0.8 向正反应方向 C Fe2++2Fe3++8OH-
-47.2 kJ/mol 10-3 mol·L-1·min-1 80%或0.8 向正反应方向 C Fe2++2Fe3++8OH-![]() Fe3O4+4H2O Fe2+容易被空气中的O2氧化为Fe3+,故需多加一些Fe2+,确保生成Fe3O4 发生副反应,Fe与H+生成H2 形成的Fe-Cu原电池增大了纳米铁粉去除NO的反应速率(或Cu2+对纳米铁粉去除NO的反应具有催化作用)
Fe3O4+4H2O Fe2+容易被空气中的O2氧化为Fe3+,故需多加一些Fe2+,确保生成Fe3O4 发生副反应,Fe与H+生成H2 形成的Fe-Cu原电池增大了纳米铁粉去除NO的反应速率(或Cu2+对纳米铁粉去除NO的反应具有催化作用)
【解析】本题主要考查铁及其化合物的性质。
(1)铁的原子结构示意图: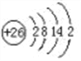 。
。
(2)3①-2②-6③得3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)△H=-47.2mol/kJ。
(3)①K=c3(CO2)/ c3(CO)=64,c(CO2)=4c(CO)=0.008mol/L,前8minCO的反应速率为0.008/8 mol·L-1·min-1=10-3 mol·L-1·min-1;平衡时a=0.08/0.1=80%或0.8。
②若再向平衡混合物中加入0.01molCO和0.02molCO2,浓度商Q<K,平衡向右移动;若要使平衡混合气中CO2的体积分数增大,下列措施可行的是C。A.增大固体用量平衡不移动,平衡混合气中CO2的体积分数不变;B.增大压强平衡不移动,平衡混合气中CO2的体积分数不变; C.降低温度平衡右移,平衡混合气中CO2的体积分数增大;D.向容器中再充入少量CO,平衡不移动,平衡混合气中CO2的体积分数不变。故选C。
(4)反应的离子方程式是Fe2++2Fe3++8OH-![]() Fe3O4+4H2O,在实际生产中Fe2+和Fe3+反应用量比常是2:3,甚至1:1,为什么?原因是Fe2+容易被空气中的O2氧化为Fe3+,故需多加一些Fe2+,确保生成Fe3O4。
Fe3O4+4H2O,在实际生产中Fe2+和Fe3+反应用量比常是2:3,甚至1:1,为什么?原因是Fe2+容易被空气中的O2氧化为Fe3+,故需多加一些Fe2+,确保生成Fe3O4。
(5)纳米铁粉可用于除去废水中的NO3-,若pH偏低将会导致NO3-的去除率下降,其原因是发生副反应,Fe与H+生成H2;若加入少量Cu2+,废水中NO3-的去除速率大大加快,可能的原因是形成的Fe-Cu原电池增大了纳米铁粉去除NO的反应速率(或Cu2+对纳米铁粉去除NO的反应具有催化作用)。


科目:高中化学 来源: 题型:
【题目】海洋中储有大量的化学物质,储量可观的化学元素就有80多种,其中70多种可以被人类提取利用,全世界每年都要从海洋中提取大量的食盐、铁、溴、碘、钾等有用物质,海水被誉为“液体工业原料”。
从海水中提取食盐、镁和溴的流程如图所示。回答下列问题:

(1)从海水中得到的粗盐中含Mg2+、CO32-、SO42- 等杂质离子,如用试剂BaCl2、NaOH、盐酸和Na2CO3溶液,除去杂质离子,则加入试剂的顺序是___________。
(2)氨碱工业的主要反应是电解饱和氯化钠溶液,写出反应的离子方程式___________。
(3)MgCl2·6H2O脱水过程中易水解生成碱式氯化镁,化学方程式为________。因此工业上常使MgCl2·6H2O晶体在____气体中脱水而得到干燥无水的MgCl2。
(4)第⑤步是用热空气将Br2吹入SO2 溶液中,写出反应的化学方程式________。
(5)电解无水MgCl2 可得金属镁和氯气,利用副产品氯气还可制备漂白粉,其反应的化学方程式为_______。
(6)步骤④中用硫酸酸化可提高Cl2 的利用率,理由是_______________________。含高浓度Br2 的水溶液经过蒸馏可得到Br2,蒸馏的温度为80~90℃,温度过高或过低都不利于生产,请解释原因:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用 NA表示阿伏加德罗常数的值,下列叙述正确的是(
A. 常温常压下,含有 NA个氮原子的氮气体积约为 11.2L
B. 标准状况下,64gSO2中含有的原子数为 3NA
C. 在常温常压下,11.2L Cl2含有的分子数为 0.5NA
D. 标准状况下,11.2L H2O 含有的分子数为 0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组在实验室中将某工厂废弃的一块合金,经过一系列的反应,制得氧化铝固体、硝酸铜晶体和铁红。其实验方案如下图。

(1)该小组所用的合金中含有的金属为铁、______、______(填名称)。
(2) 操作①、③使用的主要玻璃仪器是___________,操作②的方法:________。操作④实验操作步骤包括:______、_______(填操作名称)、过滤、洗涤、干燥。
(3)写出滤渣B中较活泼金属与足量稀硝酸发生反应的离子方程式:_______。
(4)若该小组通过上述实验流程制得铁红16g,假设实验过程中无质量损失,则合金中铁的质量为________g。
(5)上述实验流程中符合“绿色化学“理念的做法是___________(答出一点即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积固定的密闭容器中,对于反应2SO2(g)+O2(g)![]() 2SO3(g)ΔH<0。下列判断正确的是 ( )
2SO3(g)ΔH<0。下列判断正确的是 ( )
A. 增大反应体系的压强,平衡后SO2的浓度、转化率、体积分数都增加
B. 当单位时间内消耗SO2的物质的量和生成SO3的物质的量相同时,反应达到平衡状态
C. 升高温度,平衡向左移动
D. 充入SO3气体,体系压强增大,平衡向右移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如表所示,为提纯下列物质(括号内为少量杂质),所选用的除杂试剂与主要分离方法不正确的是
选项 | 不纯物质 | 除杂试剂与主要分离方法 |
A | 甲烷(乙烯) | 溴水 洗气 |
B | 己烷(癸烷) | 蒸馏(不需试剂) |
C | 乙酸乙酯(乙酸) | KOH溶液 分液 |
D | 蛋白质溶液(NaCl) | 水 渗析 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度变化如图所示。据图分析,下列判断正确的是

A. [Ksp[Cu(OH)2]<Ksp[Fe(OH)3]
B. d点代表的溶液中Fe(OH)3已过饱和、Cu(OH)2未饱和
C. 加适量NH4Cl固体可使溶液由a点变到b点
D. b、c两点代表的Fe(OH)3、Cu(OH)2溶解度相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】TiO2是一种性能优良的半导体光催化剂,能有效地吸附有机污染物(如甲醛、甲苯等)和含氮化合物(如NH3、CN-等)转化为CO2和N2等小分子物质。
(1)Ti基态核外电子排布式为________________。
(2)甲醛HCHO分子空间构型为_____;分子中碳原子轨道杂化类型为_____,π键和σ键的个数之比为____,
(3)氨气极易溶于水,是因为氨和水的分子均是_________,还因为___________。
(4)甲苯分子中能够共平面的原子最多为____个;苯环不易被卤素加成,而比较容易被卤素取代苯环上的氢,原因是___________________。
(5)含CN-的污水毒性极大,用NaClO先把CN-氧化为CNO-,然后在酸性条件下再将CNO-氧化为无污染的气体。请写出与CNO-互为等电子体的微粒______分子或离子,写一种)。
(6)Ti[(CN)4]2-中Ti2+与CN-的C原子形成配位键。不考虑空间构型,Ti[(CN)4]2-的结构可表示为_____________________。
(7)Ti的某氧化物和CaO相互作用能形成钛酸盐的晶胞结构如图所示(Ti4+位于立方体的顶点,Ca2+ 处于立方体的中心)。该晶体中,Ti4+和周围____ 个O2-相紧邻;若该晶胞的密度为dg/cm3则钛氧键的键长为______pm (用带NA的代数式表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向 50mL 稀 H2SO4 与稀 HNO3 的混合溶液中逐渐加入铁粉,假设加入铁粉的质量与产生气体的体积(标 准状况下)之间的关系如图所示,且每一段只对应一个反应。下列说法正确的是( )

A. 参加反应铁粉的总质量 m2=5.6 g
B. 所用混合溶液中 c(HNO3)=0.5 molL-1
C. 开始时产生的气体为 H2
D. AB 段产生的反应为置换反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com