
【题目】铝是应用广泛的金属,以铝土矿(主要成分为Al2O3,含SiO2和Fe2O3等杂质)为原料制备氧化铝的一种工艺流程如图。下列有关说法不正确的是( )

A.滤渣中X为Fe2O3
B.“反应”步骤中加入NaHCO3溶液后,溶液的pH增大
C.滤液中溶质的主要成分为Na2CO3
D.NaAlO2溶液呈碱性的原因:AlO2-+2H2O![]() Al(OH)3+OH-
Al(OH)3+OH-
【答案】B
【解析】
由工艺流程分析,向铝土矿中加入氢氧化钠溶液,Fe2O3不溶解,SiO2转化为硅铝酸钠,Al2O3溶解发生反应Al2O3+2NaOH===NaAlO2+H2O,过滤后得到含硅铝酸钠、Fe2O3的滤渣和NaAlO2的溶液,再向NaAlO2溶液中加入NaHCO3溶液,生成Al(OH)3沉淀,过滤,将滤渣进行灼烧得到Al2O3,据此结合选项分析。
A.根据上述分析可知,过滤后得到含硅铝酸钠、Fe2O3的滤渣,故滤渣中X为Fe2O3,A选项正确;
B.向NaAlO2溶液中加入NaHCO3溶液,发生反应NaAlO2+NaHCO3+H2O===Na2CO3+Al(OH)3↓,溶液碱性减弱,pH减小,B选项错误;
C.由B选项分析可知,滤液中溶质的主要成分为Na2CO3,C选项正确;
D.因为AlO2-为弱酸酸根,在水溶液中会发生水解反应AlO2-+2H2O![]() Al(OH)3+OH-,因此NaAlO2溶液呈碱性,D选项正确;
Al(OH)3+OH-,因此NaAlO2溶液呈碱性,D选项正确;
答案选B。


 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:
【题目】向50 mL稀H2SO4与稀HNO3的混合溶液中逐渐加入铁粉,假设加入铁粉的质量与产生气体的体积(标准状况)之间的关系如图所示,且每一段只对应一个反应。下列说法正确的是( )

A. 开始时产生的气体为H2
B. AB段发生的反应为置换反应
C. 参加反应铁粉的总质量m2=5.6 g
D. 所用混合溶液中c(HNO3)=0.5 molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙晶体(CaO2·8H2O)常温下为白色,能溶于酸,难溶于水、乙醇,是一种温和的氧化剂,常用于鱼类长途运输的增氧剂等。
(1)过氧化钙晶体可用下列方法制备:CaCl2+H2O2+2NH3+8H2O=CaO2·8H2O↓+2NH4Cl。
用如下制取装置制备过氧化钙晶体。
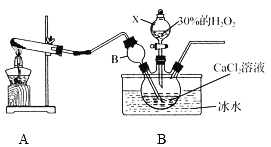
①装置A中发生反应的化学方程式为____________。
②装置C采用冰水浴控制温度在0 ℃左右,可能的原因主要有:
Ⅰ. 该反应是放热反应,温度低有利于提高CaO2·8H2O产率;
Ⅱ.__________________________________。
③反应结束后,经过滤、洗涤、低温烘干可获得CaO2·8H2O。检验晶体已洗涤干净的操作为:______。
(2)测定产品中CaO2·8H2O含量的实验步骤如下:
步骤一:准确称取a g产品于有塞锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入2 mol·L-1的硫酸溶液,充分反应(I-被氧化I2)。
步骤二:向上述锥形瓶中加入几滴淀粉溶液以指示反应的终点。
步骤三:逐滴加入浓度为c mol·L-1的Na2S2O3溶液至反应完全,滴定至终点,记录数据,再重复上述操作2次,得出3次平均消耗Na2S2O3溶液体积为V mL。发生的反应为:I2+2S2O32-=2I-+S4O62-,产品中CaO2·8H2O的质量分数为____(用含字母的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是实验室制取纯净氯气的装置图,下列说法正确的是( )
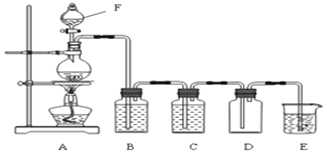
A.分液漏斗中盛装的是浓硫酸
B.B的目的是为了除去氯气中的水分
C.E的目的是为了处理过量的氯气,E中盛装的是Ca(OH)2溶液
D.D广口瓶除了可以用于收集气体外,还可以用做安全瓶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)K2Cr2O7是橙红色晶体,K2CrO4是黄色晶体,若将K2Cr2O7配成一定浓度的溶液,当达到平衡时,溶液的颜色在橙色和黄色之间,试回答:
①写出有关的离子方程式____。
②向盛有2mL的上述K2Cr2O7溶液的试管中滴入10滴2mol·L-1的NaOH溶液,试管中溶液呈___色。
③向已加入NaOH溶液的②溶液中再加入过量稀H2SO4,则溶液呈___色。
④向原溶液中逐渐加入足量Ba(NO3)2溶液(已知BaCrO4为黄色沉淀),则平衡____(填“向左移动”或“向右移动”),溶液颜色将___。
(2)现有反应:mA(g)+nB(g)![]() pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
①升高温度时,平衡向___反应方向移动,正反应为____(填“吸热”或“放热”)反应,平衡时B、C的浓度之比![]() 将____。(填“增大”“减小”或“不变”,下同)。
将____。(填“增大”“减小”或“不变”,下同)。
②减小压强时平衡向___反应方向移动, A的质量分数___,且m+n__p(填“>”或“<”)。
③若容积不变加入B,则B的转化率____,A的转化率____。
④若加入催化剂,平衡时气体混合物的总物质的量____。
⑤恒温恒容时,通入氦气,A的质量分数____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列生活常见用品中,有关物质的性质描述不正确的是( )
选项 | 生活用品 | 名称 | 主要成分 | 性质 |
A |
| PP塑料制作的奶瓶 | 聚丙烯 | 能够使酸性高锰酸钾褪色 |
B |
| 肥皂 | 高级脂肪酸钠 | 肥皂的水溶液呈碱性 |
C |
| 蜂蜜 | 葡萄糖、果糖和蔗糖 | 蔗糖在稀硫酸的作用下可水解生成葡萄糖和果糖 |
D |
| 阿胶 | 驴的皮去毛后熬制而成的胶块 | 在合适的酶的作用下能够发生水解反应 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用标准盐酸溶液测定某NaOH溶液的浓度,用甲基橙作指示剂,下列操作中可能使测定结果偏低的是( )
A.酸式滴定管在装酸液前未用标准盐酸溶液润洗2~3次
B.开始实验时酸式滴定管尖嘴部分有气泡,在滴定过程中气泡消失
C.锥形瓶内溶液颜色变化由黄色变橙色,立即记下滴定管液面所在刻度
D.盛NaOH溶液的锥形瓶滴定前用NaOH溶液润洗2~3次
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知亚磷酸(H3PO3)的结构如图![]() ,具有强还原性的二元弱酸,可以被银离子氧化为磷酸。
,具有强还原性的二元弱酸,可以被银离子氧化为磷酸。
(1)已知亚磷酸可由PCl3水解而成,请写出相应的方程式___;
(2)Na2HPO3是________(填“正盐”或“酸式盐”);
(3)亚磷酸与银离子反应时氧化剂与还原剂的物质的量之比为______________;
(4)某温度下,0.10molL-1的H3PO3溶液的pH为1.6,即c(H+)=2.5×10-2molL-1,该温度下H3PO3的一级电离平衡常数Ka1=______;(H3PO3第二步电离忽略不计,结果保留两位有效数字)
(5)向H3PO3溶液中滴加NaOH溶液至中性,所得溶液中:c(Na+)_____c(H2PO3-)+2c(HPO32-)(填“>”、“<”或“=”);
(6)向某浓度的亚磷酸中滴加NaOH溶液,其pH与溶液中的H3PO3、H2PO3—、HPO32—的物质的量分数a(X)(平衡时某物种的浓度与整个物种浓度之和的比值)的关系如图所示。
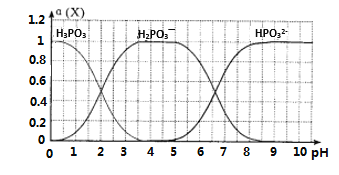
以酚酞为指示剂,当溶液由无色变为浅红色时,发生主要反应的离子方程式是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铍铜是力学、化学综合性能良好的合金,广泛应用于制造高级弹性元件。以下是从某废旧铵铜元件(含BeO25%、CuS71%、少量FeS和SiO2)中回收铍和铜两种金属的流程。
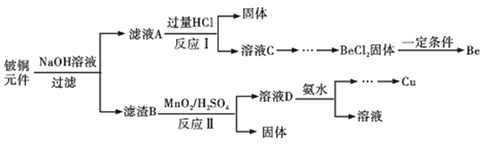
已知:
Ⅰ.铍、铝元素处于周期表中的对角线位置,化学性质相似
Ⅱ.常温下:Ksp[Cu(OH)2]=2.2×10-20,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Mn(OH)2]=2.1×10-13
(1)滤渣B的主要成分为______(填化学式);
(2)写出反应Ⅰ中含铍化合物与过量盐酸反应的化学方程式______;
(3)MnO2能将金属硫化物中的硫元素氧化为单质硫,写出反应Ⅱ中CuS发生反应的离子方程式______,若用浓HNO3溶解金属硫化物缺点是______(任写一条);
(4)从BeCl2溶液中得到BeCl2固体的操作是______。
(5)溶液D中含c(Cu2+)=2.2molL-1、c(Fe3+)=0.008molL-1、c(Mn2+)=0.01molL-1,逐滴加入稀氨水调节pH可依次分离首先沉淀的是______(填离子符号),为使铜离子开始沉淀,常温下应调节溶液的pH大于______;
(6)取铍铜元件1000g,最终获得Be的质量为72g,则Be的产率是______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com