
【题目】乙烯的分子式为C2H4,是一种重要的化工原料和清洁能源,研究乙烯的制备和综合利用具有重要意义。
请回答下列问题:
(1)乙烯的制备:工业上常利用反应C2H6(g)![]() C2H4(g)+H2(g) △H制备乙烯。
C2H4(g)+H2(g) △H制备乙烯。
已知:Ⅰ.C2H4(g)+3O2(g)=2CO2(g)+2H2O(l) △H1=-1556.8kJ·mol-1;
Ⅱ.H2(g)+![]() O2(g)=H2O(1) △H2=-285.5kJ·mol-1;
O2(g)=H2O(1) △H2=-285.5kJ·mol-1;
Ⅲ.C2H6(g)+![]() O2(g)=2CO2(g)+3H2O(l) △H3=-1559.9kJ·mol-1。
O2(g)=2CO2(g)+3H2O(l) △H3=-1559.9kJ·mol-1。
则△H=___kJ·mol-1。
(2)乙烯可用于制备乙醇:C2H4(g)+H2O(g)![]() C2H5OH(g)。向某恒容密闭容器中充入a mol C2H4(g)和 a mol H2O(g),测得C2H4(g)的平衡转化率与温度的关系如图所示:
C2H5OH(g)。向某恒容密闭容器中充入a mol C2H4(g)和 a mol H2O(g),测得C2H4(g)的平衡转化率与温度的关系如图所示:
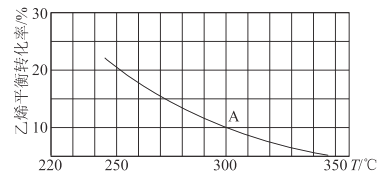
①该反应为____热反应(填“吸”或“放”),理由为____。
②A点时容器中气体的总物质的量为____。已知分压=总压×气体物质的量分数,用气体分压替代浓度计算的平衡常数叫压强平衡常数(KP),测得300℃时,反应达到平衡时该容器内的压强为b MPa,则A点对应温度下的KP=____MPa-1(用含b的分数表示)。
③已知:C2H4(g)+H2O(g)![]() C2H5OH(g)的反应速率表达式为v正=k正c(C2H4)·c(H2O),v逆=k逆c(C2H5OH),其中,k正、k逆为速率常数,只与温度有关。则在温度从250℃升高到340℃的过程中,下列推断合理的是___(填选项字母)。
C2H5OH(g)的反应速率表达式为v正=k正c(C2H4)·c(H2O),v逆=k逆c(C2H5OH),其中,k正、k逆为速率常数,只与温度有关。则在温度从250℃升高到340℃的过程中,下列推断合理的是___(填选项字母)。
A.k正增大,k逆减小 B.k正减小,k逆增大
C.k正增大的倍数大于k逆 D.k正增大的倍数小于k逆
④若保持其他条件不变,将容器改为恒压密闭容器,则300℃时,C2H4(g)的平衡转化率__10%(填“>”“<”或“=”)。
(3)乙烯可以被氧化为乙醛(CH3CHO),电解乙醛的酸性水溶液可以制备出乙醇和乙酸,则生成乙酸的电极为_____极(填“阴”或“阳”),对应的电极反应式为___。
【答案】+282.4 放 温度越高,乙烯的平衡转化率越低 1.9amol ![]() D > 阳 CH3CHO-2e-+H2O=CH3COOH+2H+
D > 阳 CH3CHO-2e-+H2O=CH3COOH+2H+
【解析】
(1)由盖斯定律Ⅲ-Ⅱ-Ⅰ可知,△H=(-1559.9kJ.mol-1)-(-285.5kJ.mol-1)-(-1556.8kJ.mol-1)=+282.4kJ·mol-1。
(2)①由图可知,温度越高,乙烯的平衡转化率越低,说明正反应是放热反应。故答案为:放,温度越高,乙烯的平衡转化率越低。
②由图可知,A点时乙烯的平衡转化率为10%,则平衡时C2H4(g)、H2O(g)、C2H5OH(g)的物质的量分别为0.9a mol、0.9a mol、0.la mol,总的物质的量为1.9amol。平衡时A点对应容器的总压强为b MPa,故C2H4(g)、H2O(g)、C2H5OH(g)的分压分别为![]() 、
、![]() 、
、![]() ,则
,则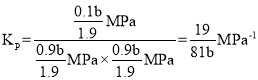 。故答案为:1.9amol,】
。故答案为:1.9amol,】![]() 。
。
③平衡时,正、逆反应速率相等,即![]() 。升高温度,正、逆反应速率都增大,即k正和k逆均增大,但由于正反应是放热反应,K减小,故k正增大的倍数小于k逆。故选D。
。升高温度,正、逆反应速率都增大,即k正和k逆均增大,但由于正反应是放热反应,K减小,故k正增大的倍数小于k逆。故选D。
④正反应为气体物质的量减小的反应,平衡时,与恒容容器相比,恒压密闭容器压强更大,反应正向进行程度更大,C2H4(g)的平衡转化率更高。故答案为:>。
(3)乙醛在阳极发生氧化反应生成乙酸,电极反应式为CH3CHO-2e-+H2O===CH3COOH+2H+。故答案为:阳,CH3CHO-2e-+H2O===CH3COOH+2H+。


科目:高中化学 来源: 题型:
【题目】青蒿素是烃的含氧衍生物,为无色针状晶体,易溶于丙酮、氯仿和苯中,在甲醇、乙醇、乙醚、石油醚中可溶解,在水中几乎不溶,熔点为156~157℃,热稳定性差,青蒿素是高效的抗疟药。已知:乙醚沸点为35℃。从青蒿中提取青蒿素的方法之一是以萃取原理为基础的,主要有乙醚浸取法和汽油浸取法。乙醚浸取法的主要工艺为:
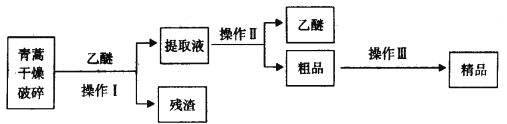
请回答下列问题:
(1)对青蒿进行干燥破碎的目的是_____________。
(2)操作I需要的玻璃仪器主要有:烧杯、_________,操作Ⅱ的名称是_______________。
(3)操作Ⅲ的主要过程可能是_____________(填字母)。
A.加水溶解,蒸发浓缩、冷却结晶
B.加95%的乙醇,浓缩、结晶、过滤
C.加入乙醚进行萃取分液
(4)用下列实验装置测定青蒿素分子式的方法如下:将28.2g青蒿素样品放在硬质玻璃管C中,缓缓通入空气数分钟后,再充分燃烧,精确测定装置E和F实验前后的质量,根据所测数据计算。
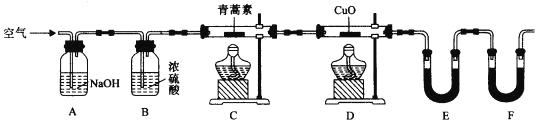
①装置E中盛放的物质是______________,装置F中盛放的物质是________________。
②该实验装置可能会产生误差,造成测定含氧量偏低,改进方法是_______________。
③用合理改进后的装置进行试验,称得:
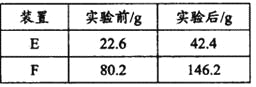
则测得青蒿素的最简式是__________________。
(5)某学生对青蒿素的性质进行探究。将青蒿素加入含有NaOH、酚酞的水溶液中,青蒿素的溶解量较小,加热并搅拌,青蒿素的溶解量增大,且溶液红色变浅,说明青蒿素与____________(填字母)具有相同的性质。
A.乙醇 B.乙酸 C.乙酸乙酯 D.葡萄糖
(6)某科研小组经多次提取青蒿素实验认为用石油醚做溶剂较为适宜,实验中通过控制其他实验条件不变,来研究原料的粒度、提取时间和提取温度对青蒿素提取速率的影响,其结果如下图所示:
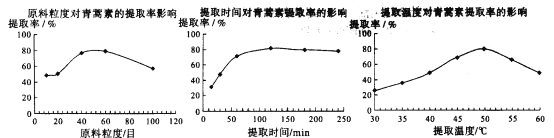
由上图可知控制其他实验条件不变,采用的最佳粒度、时间和温度为_______________。
A.80目、100分钟、50℃ B.60目、120分钟、50℃ C.60目、120分钟、55℃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由A、B、C、D四种金属按下表中装置进行实验。
装置 |
|
|
|
现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
根据实验现象回答下列问题:
(1)装置甲中负极的电极反应式是______________________________________。
(2)装置乙中正极的电极反应式是_______________________________________。
(3)装置丙中溶液的pH________(填“变大”、“变小”或“不变”)。
(4)四种金属活动性由强到弱的顺序是___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯氢硅(SiHCl3)是制备硅烷、多晶硅的重要原料。回答下列问题:
(1)SiHCl3在催化剂作用下发生反应:
2SiHCl3(g)=SiH2Cl2(g)+ SiCl4(g) ΔH1=48 kJ·mol-1
3SiH2Cl2(g)=SiH4(g)+2SiHCl3 (g) ΔH2=30 kJ·mol-1
则反应4SiHCl3(g)=SiH4(g)+3SiCl4(g)的ΔH=__________kJ·mol-1。
(2)对于反应2SiHCl3(g)=SiH2Cl2(g)+SiCl4(g),采用大孔弱碱性阴离子交换树脂催化剂,在323K和343K时SiHCl3的转化率随时间变化的结果如图所示。
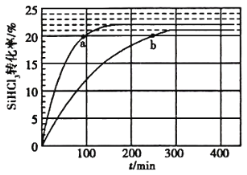
① 343K时反应的平衡转化率α=__________%。平衡常数表达式__________。
②在343K下,要提高SiHCl3转化率,可采取的措施是__________;要缩短反应达到平衡的时间,可采取的措施有__________、__________。
③比较a、b处反应速率大小:va__________vb(填“大于”“小于”或“等于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有一份澄清溶液, 可能含有 Na+、 K+、 NH4+、 Ca2+、 Fe3+、 SO42-、 CO32-、 SO32-、 Cl-、I-中的若干种, 且离子的物质的量浓度均为 0.1 mol·L-1(不考虑水解和水的电离)。 往该溶液中加入过量的盐酸酸化的 BaCl2 溶液, 无沉淀生成。 另取少量原溶液, 设计并完成如下实验:
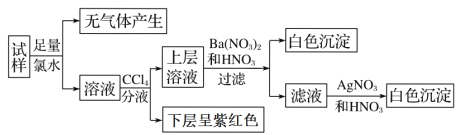
则关于原溶液的判断中不正确的是
A. 是否存在 Na+、K+需要通过焰色反应来确定
B. 通过CCl4 层的颜色变化,也能判断出原溶液中是否存在Fe3+
C. 虽然实验过程引入了氯元素, 但不影响原溶液是否存在Cl-的判断
D. 肯定不存在的离子是 Ca2+、Fe3+、SO42-、CO32-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年是“国际化学元素周期表年”(IYPT2019)。我国华东师范大学80后科学家姜雪峰教授被遴选为硫元素的代言人。其课题组运用“从无机硫向有机硫”转化的理念,构建起了“3S绿色硫化学”。下列有关S的说法正确的是( )
A.位于元素周期表中第三周期第VA族
B.硫元素原子结构示意图: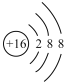
C.![]() S原子的中子数是32
S原子的中子数是32
D.有机化合物中可能含有硫元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用示意图或图示的方法能够直观形象地将化学知识传授给学生,下列示意图或图示正确的是( )
A.砷原子的结构示意图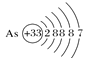 B.BF4—的结构式
B.BF4—的结构式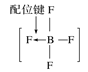
C.HF分子间的氢键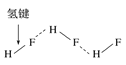 D.丙氨酸的手性异构
D.丙氨酸的手性异构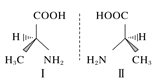
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌灰是炼锌厂的烟道灰,含ZnO 35%以上,还含有少量的氧化锰(MnO)、氧化铜、 铁的氧化物和不溶于酸的杂质,工业上常用酸浸法回收 ZnSO4·7H2O。已知 ZnSO4·7H2O 晶体易溶于水,难溶于酒精,某兴趣小组实验室模拟回收 ZnSO4·7H2O 晶体,流程如下:

请回答:
(1)分析步骤 II 中的操作和原理, 回答下列问题:
①结合表 1、 2,分析选择的 pH 及温度分别是______________________, 其中, 可以采用加入_________________________来调节 pH ;
表1 pH对ZnSO4.7H2O 回收量及纯度的影响
pH | ZnSO4.7H2O 回收量(g) | 产品中Fe的含量% | 产品中其他重金属含量% |
1 | 114.32 | 0.750 | 0.059 |
2 | 114.4 | 0.086 | 0.056 |
3 | 113.68 | 0.034 | 0.054 |
4 | 113.60 | 0.010 | 0.050 |
5 | 112.43 | 0.010 | 0.050 |
表2 温度对ZnSO4.7H2O 回收量及纯度的影响
温度 (℃) | ZnSO4.7H2O 回收量(g) | 产品中F的含量% | 产品中其他重金属含量% |
20 | 111.45 | 0.011 | 0.052 |
40 | 112.89 | 0.010 | 0.051 |
60 | 113.30 | 0.010 | 0.050 |
80 | 113.80 | 0.010 | 0.050 |
90 | 114.40 | 0.091 | 0.048 |
②酸性 KMnO4 溶液将溶液中的 Fe2+氧化,生成两种沉淀;同时,过量的高锰酸钾在微酸性的条件能自动分解生成MnO2 沉淀。试写出在该环境下,KMnO4 溶液氧化 Fe2+的离子反应方程式_________________________________________。 若用稀硝酸做氧化剂,除了产物中可能含有 Zn(NO3)2 外,还可能的缺点是:_________________________;
(2)分析整个实验过程中,回答下列问题:
①滤渣 B 的主要成分为___________________________;
②如何检验滤液B中是否含有铁元素_____________________________________;
③写出生成滤渣C的离子方程式__________________________________________;
(3)为测定 ZnSO4·7H2O 晶体的纯度,可用 K4Fe(CN)6 标准液进行滴定。主要原理如下:2K4Fe(CN)6+ 3ZnSO4= K2Zn3[Fe(CN)6]2↓+ 3K2SO4
准确称取 5.000g ZnSO4·7H2O 晶体,用蒸馏水溶解并定容至 250mL,准确移取该溶液 25.00mL至锥形瓶中,用 0.0500mol/L K4Fe(CN)6 溶液进行滴定,所得数据如下表:
实验次数 | 滴定前读数/mL | 滴定后读数/mL |
1 | 0.10 | 19.92 |
2 | 1.34 | 21.12 |
3 | 0.00 | 20.10 |
则 ZnSO4·7H2O 晶体的纯度是_______________(以质量分数表示,保留到小数点后两位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】催化剂在生产和科技领域起到重大作用。为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题:

(1)定性如图甲可通过观察_____________,定性比较得出结论。同学X观察甲中两支试管产生气泡的快慢,由此得出Fe3+和Cu2+对H2O2分解的催化效果,其结论__________(填“合理”或“不合理”),理由是___________
(2)定量如图乙所示,实验时均以生成40 mL气体为准,其它可能影响实验的因素均已忽略。实验中需要测量的数据是_____________________。
(3)加入0.10 mol MnO2粉末于50 mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图所示。
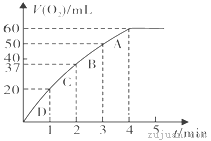
①实验时放出气体的总体积是__________mL。
②放出1/3气体所需时间为___________min。
③计算H2O2的初始物质的量浓度_______________。 (请保留两位有效数字)
④A、B、C、D各点反应速率快慢的顺序为_____>____>____>____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com