
����Ŀ���������(SiHCl3)���Ʊ����顢�ྦྷ�����Ҫԭ�ϡ��ش��������⣺
(1)SiHCl3�ڴ��������·�����Ӧ��
2SiHCl3(g)=SiH2Cl2(g)+ SiCl4(g) ��H1=48 kJ��mol-1
3SiH2Cl2(g)=SiH4(g)+2SiHCl3 (g) ��H2=30 kJ��mol-1
��Ӧ4SiHCl3(g)=SiH4(g)+3SiCl4(g)�Ħ�H=__________kJ��mol-1��
(2)���ڷ�Ӧ2SiHCl3(g)=SiH2Cl2(g)+SiCl4(g)�����ô�������������ӽ�����֬��������323K��343KʱSiHCl3��ת������ʱ��仯�Ľ����ͼ��ʾ��
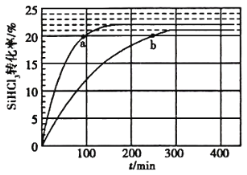
�� 343Kʱ��Ӧ��ƽ��ת���ʦ�=__________%��ƽ�ⳣ������ʽ__________��
����343K�£�Ҫ���SiHCl3ת���ʣ��ɲ�ȡ�Ĵ�ʩ��__________��Ҫ���̷�Ӧ�ﵽƽ���ʱ�䣬�ɲ�ȡ�Ĵ�ʩ��__________��__________��
�۱Ƚ�a��b����Ӧ���ʴ�С��va__________vb(����ڡ���С�ڡ����ڡ�)��
���𰸡�+114 22 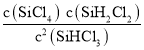 ��ʱ��������� ����ѹǿ ʹ�ô����� ����
��ʱ��������� ����ѹǿ ʹ�ô����� ����
��������
(1)SiHCl3�ڴ��������·�����Ӧ��
2SiHCl3(g)=SiH2Cl2(g)+ SiCl4(g) ��H1=48 kJ��mol-1
3SiH2Cl2(g)=SiH4(g)+2SiHCl3 (g) ��H2=30 kJ��mol-1
�ѵ�һ����Ӧ����3��͵ڶ�����Ӧ��ӣ����ɵ÷�Ӧ4SiHCl3(g)=SiH4(g)+3SiCl4(g)������H=3��H1+��H2=3��48 kJ��mol-1+(30 kJ��mol-1)=+144kJ��mol-1��
(2) ���¶�Խ�ߣ���Ӧ����Խ�죬Խ�ȴﵽƽ�⣬����ͼ����a�����ڵ������¶ȸߣ���Ϊ343K�µ����ߡ������߿��Կ�����ƽ��ʱSiHCl3��ת����Ϊ22%��ƽ�ⳣ��Ϊƽ��ʱ������Ũ����֮�����Է�Ӧ��Ũ����֮�����ʷ�Ӧ2SiHCl3(g)=SiH2Cl2(g)+SiCl4(g)��ƽ�ⳣ������ʽΪK=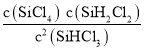 ���ʴ�Ϊ22��
���ʴ�Ϊ22��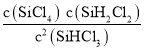 ��
��
����343K�£�Ҫ���SiHCl3ת���ʣ���Ҫʹƽ�������ƶ���Ӱ��ƽ���������Ũ�ȡ��¶ȡ�ѹǿ�ȣ������¶�һ�������÷�Ӧ��ǰ������ϵ������ȣ�ѹǿ�ı䲻��ʹƽ���ƶ�������ֻ�ܲ�ȡ��ʱ�������Ĵ�ʩ����߷�Ӧ���ת���ʡ�Ҫ���̷�Ӧ�ﵽƽ���ʱ�䣬��Ҫ��߷�Ӧ���ʣ���Ӱ�췴Ӧ���ʵ�����Ũ�ȡ��¶ȡ�ѹǿ�ʹ����ȷ��濼�ǣ��ɲ�ȡ�Ĵ�ʩ������ѹǿ��������Ӧ��Ũ�ȣ���ʹ�ô����ȡ��ʴ�Ϊ����ʱ������������ѹǿ��ʹ�ô����ȡ�
��a��b������Ӧ���ת������ȣ����Ը����ʵ�Ũ����ȣ���a���¶ȸ���b���¶ȣ��¶�Խ�ߣ���Ӧ����Խ�죬���Է�Ӧ���ʣ�va����vb��


 ȫ�ŵ�����Ԫ�ƻ�ϵ�д�
ȫ�ŵ�����Ԫ�ƻ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ǰ����������Ԫ��X��Y��M��N����Ϣ���£�
�й���Ϣ | |
X | XԪ�ص�ԭ�������������ǵ��Ӳ�����3�� |
Y | YԪ������������������������֮��Ϊ4��Y��ͬ������ԭ�Ӱ뾶��С��Ԫ�� |
M | �����µ��ʳ�Һ̬�ķǽ���Ԫ�� |
N | N�Ļ�����������ʱ��ɫ�ʻ�ɫ |
��ش��������⣺
(1)MԪ�������ڱ��е�λ��______________________��
(2)YԪ�صļ������ӽṹʾ��ͼ_______________��
(3)������N2X2�ĵ���ʽΪ_______________����д������һ����;_______________��
(4)��Ʒ���֤��M��YԪ�صĵõ�������ǿ����______________________________________��
(5)Y�ĵ�����һ����Ҫ�Ļ���ԭ�ϣ��ڹ�ũҵ������������������Ҫ��Ӧ�á�Ϊ̽��Y���ʵ����ʣ�ijͬѧ�������ͼ��ʾ��ʵ��װ�á�
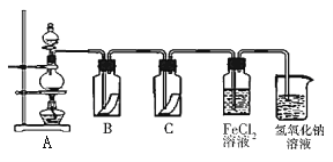
��ʵ������ȡ����Ļ�ѧ����ʽΪ��__________________________________________���÷�Ӧ���������ͻ�ԭ�������ʵ���֮��Ϊ_________________________
��װ��B��C�����ηŵ��Ǹ���ĺ�ɫ������ʪ��ĺ�ɫ������������װ��_____�еĺ�ɫ������ɫ����ʵ������и�ͬѧ����װ��B��C�еIJ�������ɫ����ԭ�������_________________��
��д����������FeCl2��Һ��Ӧ�����ӷ���ʽ____________________________________��
�ܹ�ҵ�ϳ���ʯ���������Ƹ������Ƶ�Ư�ۣ�Ư�۵ı����ܷⱣ�棬������ʧЧ��ԭ����____(�û�ѧ����ʽ��ʾ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ۺ���F�ĺϳ�·��ͼ��ͼ��

��֪��HCHO+RCH2CHO![]()
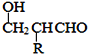
![]()
![]()
��ݴ˻ش�
��1��A�к���������������________________��C��ϵͳ����Ϊ_____________________ ��
��2������B���������������õ��Լ���______________��_____________��E��F�ķ�Ӧ������______________��B+D![]() E�ķ�Ӧ������______________________��
E�ķ�Ӧ������______________________��
��3��д��A��B�Ļ�ѧ����ʽ__________________________________________________��
��4��д��C��D�Ļ�ѧ����ʽ__________________________________________________��
��5�����������ϳ�·�ߣ����һ���ɼ�ȩ����ȩ�ͼ״�Ϊ��Ҫԭ���Ʊ�![]() �ĺϳ�·��_______________________________________________________________
�ĺϳ�·��_______________________________________________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ˮϵ�����ӵ�ذ�ȫ���ܺá��۸�������Ի����Ѻã����ž���г�ǰ����ij�����ӵ�ع���ԭ����ͼ������ܷ�ӦΪ��2NaFePO4F + Na3Ti2(PO4)3![]() 2Na2FePO4F+ NaTi2(PO4)3
2Na2FePO4F+ NaTi2(PO4)3
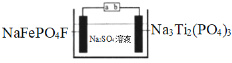
����˵���������
A.���ʱ��a�ӵ�Դ����
B.�ŵ�ʱ����Һ�е�Na+��NaFePO4F�缫�ϵõ��ӱ���ԭ
C.���ʱ�������ϵĵ缫��ӦΪNaTi2(PO4)3+2Na++2e��=Na3Ti2(PO4)3
D.�����ϣ��õ���ڳ���ŵ��������Һ�е�c(Na+)����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ԫ�����ڱ���ѧϰ��ѧ����Ҫ����,������������Ϣ���ɡ��±����������ֶ�����Ԫ�ص�ԭ�Ӱ뾶����Ҫ���ϼ�(��֪��Ԫ�ص�ԭ�Ӱ뾶Ϊ0.089 nm)��
Ԫ�ش��� | A | B | C | D | X | Y |
ԭ�Ӱ뾶/nm | 0.037 | 0.143 | 0.102 | 0.099 | 0.074 | 0.075 |
��Ҫ���ϼ� | +1 | +3 | +6,-2 | -1 | -2 | +5,-3 |
��1��CԪ�������ڱ��е�λ��Ϊ________�������ӽṹʾ��ͼΪ��_______��
��2��B������������Ӧ��ˮ������Y������������Ӧ��ˮ���ﷴӦ�����ӷ���ʽΪ___��
��3������C��D ����Ԫ��˵����ȷ����__________������ţ���
a.�����ӵİ뾶D>C b.��̬�⻯����ȶ���D��Cǿ c.����������Ӧ��ˮ���������C��Dǿ
��4����100mL18mol/L��C������������Ӧ��ˮ�����Ũ��Һ�м��������ͭƬ������ʹ���ַ�Ӧ��������������Ϊ6.72L(����£�����÷�Ӧ������ת�Ƶĵ�����Ϊ______��
��5��д����A��D��X����Ԫ����ɵ�ij�ֿ�������ɱ�����ʵĵ���ʽ_____________��
��6���Ƚ�YԪ������ͬ�������Ԫ�ص��⻯����۷е�ߵ�__ ��___ (���⻯�ﻯѧʽ��������___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и�����ȷ���ǣ� ��
A.NH4HCO3����������������Һ��Ӧ�����ӷ���ʽ��HCO3-+OH-=CO32-+H2O
B.����ˮ������Ӧ�Ļ�ѧ����ʽ��2Fe+3H2O(g)=Fe2O3+3H2
C.FeSO4������Һ��¶�ڿ����У�4Fe2++O2+4H+=4Fe3++2H2O
D.�ƺ�����ͭ��Һ��Ӧ�����ӷ���ʽ��2Na+Cu2+=2Na++Cu
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ϩ�ķ���ʽΪC2H4����һ����Ҫ�Ļ���ԭ�Ϻ������Դ���о���ϩ���Ʊ����ۺ����þ�����Ҫ���塣
��ش��������⣺
��1����ϩ���Ʊ�����ҵ�ϳ����÷�ӦC2H6��g��![]() C2H4��g��+H2��g�� ��H�Ʊ���ϩ��
C2H4��g��+H2��g�� ��H�Ʊ���ϩ��
��֪����C2H4��g��+3O2��g��=2CO2��g��+2H2O��l�� ��H1=-1556.8kJ��mol-1��
��H2��g��+![]() O2��g��=H2O��1�� ��H2=-285.5kJ��mol-1��
O2��g��=H2O��1�� ��H2=-285.5kJ��mol-1��
��C2H6��g��+![]() O2��g��=2CO2��g��+3H2O��l�� ��H3=-1559.9kJ��mol-1��
O2��g��=2CO2��g��+3H2O��l�� ��H3=-1559.9kJ��mol-1��
���H=___kJ��mol-1��
��2����ϩ�������Ʊ��Ҵ���C2H4��g��+H2O��g��![]() C2H5OH��g������ij�����ܱ������г���a mol C2H4��g���� a mol H2O��g�������C2H4��g����ƽ��ת�������¶ȵĹ�ϵ��ͼ��ʾ��
C2H5OH��g������ij�����ܱ������г���a mol C2H4��g���� a mol H2O��g�������C2H4��g����ƽ��ת�������¶ȵĹ�ϵ��ͼ��ʾ��
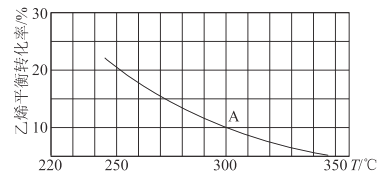
�ٸ÷�ӦΪ____�ȷ�Ӧ��������š���������Ϊ____��
��A��ʱ����������������ʵ���Ϊ____����֪��ѹ=��ѹ���������ʵ����������������ѹ���Ũ�ȼ����ƽ�ⳣ����ѹǿƽ�ⳣ����KP�������300��ʱ����Ӧ�ﵽƽ��ʱ�������ڵ�ѹǿΪb MPa����A���Ӧ�¶��µ�KP=____MPa-1���ú�b�ķ�����ʾ����
����֪��C2H4��g��+H2O��g��![]() C2H5OH��g���ķ�Ӧ���ʱ���ʽΪv��=k��c��C2H4����c��H2O����v��=k��c��C2H5OH�������У�k����k��Ϊ���ʳ�����ֻ���¶��йء������¶ȴ�250�����ߵ�340��Ĺ����У������ƶϺ�������___����ѡ����ĸ����
C2H5OH��g���ķ�Ӧ���ʱ���ʽΪv��=k��c��C2H4����c��H2O����v��=k��c��C2H5OH�������У�k����k��Ϊ���ʳ�����ֻ���¶��йء������¶ȴ�250�����ߵ�340��Ĺ����У������ƶϺ�������___����ѡ����ĸ����
A��k������k����С B��k����С��k������
C��k������ı�������k�� D��k������ı���С��k��
�������������������䣬��������Ϊ��ѹ�ܱ���������300��ʱ��C2H4��g����ƽ��ת����__10%���>����<����=������
��3����ϩ���Ա�����Ϊ��ȩ��CH3CHO���������ȩ������ˮ��Һ�����Ʊ����Ҵ������ᣬ����������ĵ缫Ϊ_____���������������������Ӧ�ĵ缫��ӦʽΪ___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ���ǣ� ��
A.XeԪ�ص��������ԭ�ӵļ۵����Ų�ʽ��Ϊns2np6�����ڷǽ���Ԫ��
B.��Ԫ�����ڱ��У�s����d����ds����Ԫ�ض��ǽ���(��Ԫ�س���)
C.ij��̬ԭ�ӵĺ�������Ų�ͼΪ![]() ����Υ��������ԭ��
����Υ��������ԭ��
D.ij�۵����Ų�Ϊ3d14s2�Ļ�̬ԭ�ӣ���Ԫ��λ�����ڱ��е������ڵڢ�B��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͼװ��̽��ͭ���������Լ��ķ�Ӧ�����Թ��м���һ����ͭ�ۣ������Լ�����������������ʵ���������±���ʾ�������ƶ�����ȷ����( )
���ϣ�Cu2++4NH3![]() [Cu(NH3)4]2+, [Cu(NH3)4]2+�����ɫ��
[Cu(NH3)4]2+, [Cu(NH3)4]2+�����ɫ��
װ�� | ��� | �Լ� | ���� |
| �� | 10 mLŨNH3��H2O��3 mLH2O | ��Һ��Ϊ���ɫ�����ˮ������ |
�� | 10 mLŨNH3��H2O��3 mL H2O2 | ��Һ��Ϊ���ɫ���ұȢ��� | |
�� | 10 mL 20% HNO3��Һ��3 mL H2O | ��Һ���ٱ�����������ɫ���壬���ˮ���½� | |
�� | 10 mL 20% HNO3��Һ��3 mL H2O2 | ��Һ�����Ȣ�����������ɫ���壬���ˮ���½� |
A.����ʵ������˵��O2�����˷�Ӧ
B.������Һ��ɫ�Ȣ������������H2O2����Cu����Cu2+
C.�������ˮ���½������Ƿ�Ӧ����NO���嵼�µ�
D.�ܱȢ۱�����������H2O2�ֽ������������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com