
【题目】下列各项正确的是( )
A.NH4HCO3与足量氢氧化钠溶液反应的离子方程式:HCO3-+OH-=CO32-+H2O
B.铁与水蒸气反应的化学方程式:2Fe+3H2O(g)=Fe2O3+3H2
C.FeSO4酸性溶液暴露在空气中:4Fe2++O2+4H+=4Fe3++2H2O
D.钠和硫酸铜溶液反应的离子方程式:2Na+Cu2+=2Na++Cu
 新思维寒假作业系列答案
新思维寒假作业系列答案科目:高中化学 来源: 题型:
【题目】为了除去KCl溶液中少量的MgCl2、MgSO4,可选用Ba(OH)2、HCl和K2CO3三种试剂,按如下步骤操作:
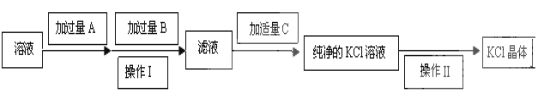
(1)写出上述试剂的化学式:A_____________________。
(2)上述操作Ⅰ所用玻璃仪器的名称是__________________;操作Ⅱ的名称是_____________。
(3)加过量A时发生有关反应的离子反应方程式为:_________________、__________________。
(4)检验试剂B是否过量的方法:__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可用以下方法处理尾气中的SO2。
方法一:活性炭还原法:
反应原理:恒温恒容2C(s)+2SO2(g)![]() S2(g)+2CO2(g)+Q
S2(g)+2CO2(g)+Q
反应进行到不同时间测得各物质的浓度如图:
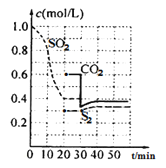
(1)第一次达到平衡的时间是第___min;0~20min化学反应速率表示v(SO2)=___。
(2)30min时平衡发生移动的条件是___。
(3)40min时,平衡常数的计算式为___。(指代入具体数值的算式)
方法二:亚硫酸钠吸收法
(4)Na2SO3溶液吸收SO2的离子方程式为___;
(5)如图是Na2SO3溶液中各离子浓度的相对大小关系示意图。
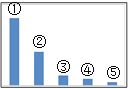
其中③是___。(填微粒符号)
常温下,当吸收至pH=6时,吸收液中相关离子浓度关系一定正确的是__(填序号)
a.c(Na+)+c(H+)>c(SO32-)+c(HSO3-)+c(OH-)
b.c(Na+)=c(SO32-)+c(HSO3-)+c(H2SO3)
c.水电离出c(OH一)=1×l0-8mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸是日常生活中最常见的调味剂和重要的化工原料,醋酸钠是其常见的盐(已知:25℃,Ka(CH3COOH)=1.69×10-5)。
(1)醋酸钠溶液呈碱性的原因是_______________(写出有关的离子方程式)
(2)在CH3COONa溶液中离子浓度由大到小的顺序为_____________________(用c(Bn+)表示相应离子浓度);
(3)25℃时,0.10mol/L的醋酸溶液的pH约为___________(已知:lg1.3=0.114);
(4)对于醋酸溶液和醋酸钠溶液的下列说法正确的是____________;
A.稀释醋酸溶液,醋酸的电离程度增大,而稀释醋酸钠溶液则醋酸钠的水解程度减小.
B.升高温度可以促进醋酸电离,也可以促进醋酸钠水解.
C.醋酸和醋酸钠混合液中,醋酸抑制醋酸钠的水解、醋酸钠也抑制醋酸的电离.
D.醋酸和醋酸钠混合液中,醋酸促进醋酸钠的水解、醋酸钠也促进醋酸的电离.
(5)物质的量浓度均为0.1mol/L的CH3COONa和CH3COOH溶液等体积混合(注:混合前后溶液体积变化忽略不计),混合液中的下列关系式正确的是_______;
A.c(CH3COOH)+2c(H+)=c(CH3COO-)+2c(OH-)
B.c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
C.c(CH3COO-)+c(CH3COOH)=0.1mol/L
(6)常温时,有以下3种溶液,其中pH最小的是____________;
A.0.02molL-1CH3COOH与0.02molL-1NaOH溶液等体积混合液
B.0.03molL-1CH3COOH与0.01molL-1NaOH溶液等体积混合液
C.pH=2的CH3COOH与pH=12的NaOH溶液等体积混合液
(7)用pH试纸在常温下分别测定0.10mol/L的醋酸钠溶液和0.10mol/L的碳酸钠溶液,则pH(CH3COONa)_______ pH(Na2CO3).(填:“>”、“<”或“=”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯氢硅(SiHCl3)是制备硅烷、多晶硅的重要原料。回答下列问题:
(1)SiHCl3在催化剂作用下发生反应:
2SiHCl3(g)=SiH2Cl2(g)+ SiCl4(g) ΔH1=48 kJ·mol-1
3SiH2Cl2(g)=SiH4(g)+2SiHCl3 (g) ΔH2=30 kJ·mol-1
则反应4SiHCl3(g)=SiH4(g)+3SiCl4(g)的ΔH=__________kJ·mol-1。
(2)对于反应2SiHCl3(g)=SiH2Cl2(g)+SiCl4(g),采用大孔弱碱性阴离子交换树脂催化剂,在323K和343K时SiHCl3的转化率随时间变化的结果如图所示。
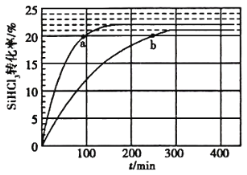
① 343K时反应的平衡转化率α=__________%。平衡常数表达式__________。
②在343K下,要提高SiHCl3转化率,可采取的措施是__________;要缩短反应达到平衡的时间,可采取的措施有__________、__________。
③比较a、b处反应速率大小:va__________vb(填“大于”“小于”或“等于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、NO的混合气体4.48L(气体体积均在标准状况下测定,下同),这些气体与一定体积氧气混合后通入水中,所有气体完全被水吸收生成硝酸,若向所得硝酸铜溶液中加入5mol/LNaOH溶液至Cu2+恰好完全沉淀,消耗NaOH溶液的体积是60mL。下列说法不正确的是![]()
![]()
A.此反应过程中转移的电子为0.6mol
B.消耗氧气的体积是1.68L
C.混合气体中含NO23.36L
D.参加反应的硝酸是0.5mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年是“国际化学元素周期表年”(IYPT2019)。我国华东师范大学80后科学家姜雪峰教授被遴选为硫元素的代言人。其课题组运用“从无机硫向有机硫”转化的理念,构建起了“3S绿色硫化学”。下列有关S的说法正确的是( )
A.位于元素周期表中第三周期第VA族
B.硫元素原子结构示意图: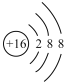
C.![]() S原子的中子数是32
S原子的中子数是32
D.有机化合物中可能含有硫元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,恒容密闭容器中,反应2HI(g)![]() H2(g)+I2(g,紫色),下列不能说明已达平衡状态的是( )
H2(g)+I2(g,紫色),下列不能说明已达平衡状态的是( )
A.各物质的浓度不再变化B.混合体颜色不再变化
C.HI、H2、I2的物质的量浓度之比为2:1:1D.HI的质量不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟及其化合物用途非常广泛。回答下列问题:
(1)聚四氟乙烯是一种准晶体,准晶体是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过___方法区分晶体准晶体和非晶体。
(2)[H2F]+[SbF6]-(氟锑酸)是一种超强酸,存在[H2F]+,该离子的空间构型为___。
(3)NH4F(氟化铵)可用于玻璃的蚀刻、防腐剂、消毒剂。氟化铵溶液中存在__(填字母)。
a.离子键 b.σ键 c.π键 d.氢键 e.配位键
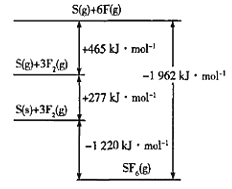
(4)SF6被广泛用作高压电气设备的绝缘介质。SF6是一种共价化合物,可通过类似于Born-Haber循环能量构建能量图计算相关键能。则F-F键的键能为____kJmol-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com