
【题目】有机乙偶姻存在于啤酒中,是酒类调香中一个极其重要的品种,某研究性学习小组为确定乙偶姻的结构,进行如下探究。
步骤一:将乙偶姻蒸气通过热的氧化铜(催化剂)氧化成二氧化碳和水,再用装有无水氯化钙和固体氢氧化钠的吸收管完全吸收,如图1。2.64 g乙偶姻的蒸气氧化产生5.28 g二氧化碳和2.16 g水。
步骤二:升温使乙偶姻汽化,测其密度是相同条件下H2的44倍
步骤三:用核磁共振仪测出乙偶姻的核磁共振氢谱如图2,图中4个峰的面积比为1∶3∶1∶3。
步骤四:利用红外光谱仪测得乙偶姻分子的红外光谱如图3。



(1)图1装置中两支U型管不能互换的理由是__________________________.
(2)乙偶姻的摩尔质量为____________。
(3)乙偶姻的分子式为____________________。
(4)乙偶姻的结构简式为 ________________。
【答案】气体通过NaOH时同时会吸收水蒸气和CO2,干扰元素的验证 88g/mol C4H8O2 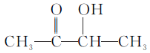
【解析】
步骤一:无水氯化钙能够吸水,2.16 g水的物质的量为2.16/18=0.12mol ;固体氢氧化钠能够吸收二氧化碳,5.28 g二氧化碳的物质的量为5.28/44=0.12mol ;n(C)= n(CO2)= 0.12 mol, m(C)= 0.12×12=1.44g;n(H)=2n(H2O)=0.24mol,m(H)= 0.24×1=0.24 g,因此m(O)= 2.64-1.44-0.24=0.96g, n(O)=0.96/16=0.06 mol;因此n(C):n(H);n(O)= 0.12:0.24:0.06=4:8:1,最简式为C2H4O;
步骤二:根据M1/M2=ρ1/ρ2=D(气体相对密度),据此可以求出该有机物的摩尔质量为88 g/mol,根据(C2H4O)n=88,求出n=2,确定该有机物的分子式;
步骤三:用核磁共振仪测出乙偶姻的核磁共振氢谱如图2,图中4个峰的面积比为1∶3∶1∶3;结构中含有2个甲基;
步骤四:利用红外光谱仪测得乙偶姻分子的红外光谱如图3,由此可知该有机物的结构简式为: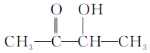 ;据以上分析解答。
;据以上分析解答。
步骤一:无水氯化钙能够吸水,2.16 g水的物质的量为2.16/18=0.12mol;固体氢氧化钠能够吸收二氧化碳,5.28 g二氧化碳的物质的量为5.28/44=0.12mol ;n(C)= n(CO2)= 0.12 mol, m(C)= 0.12×12=1.44g;n(H)=2n(H2O)=0.24mol,m(H)= 0.24×1=0.24 g,因此m(O)= 2.64-1.44-0.24=0.96g, n(O)=0.96/16=0.06 mol;因此n(C):n(H);n(O)= 0.12:0.24:0.06=4:8:1,最简式为C2H4O;
步骤二:测该有机物密度是相同条件下H2的44倍,根据M1/M2=ρ1/ρ2=D(气体相对密度)可知,该有机物的分子量为88,(C2H4O)n=88,n=2,所以该有机物的分子式为C4H8O2;
步骤三:用核磁共振仪测出乙偶姻的核磁共振氢谱如图2,图中4个峰的面积比为1∶3∶1∶3;结构中含有2个甲基;
步骤四:利用红外光谱仪测得乙偶姻分子的红外光谱如图3,由此可知该有机物的结构简式为: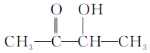 ;
;
(1)结合以上分析可知,气体先通过无水氯化钙,可以测定出水的质量,通过固体氢氧化钠吸收二氧化碳,测定出二氧化碳的质量;而二者互换,气体通过NaOH时同时会吸收水蒸气和CO2,干扰氢、碳元素的验证;综上所述,本题答案是:气体通过NaOH时同时会吸收水蒸气和CO2,干扰元素的验证。
(2)结合以上分析可知,乙偶姻的摩尔质量为88g/mol;综上所述,本题答案是: 88g/mol。
(3)结合以上分析可知,乙偶姻的分子式为C4H8O2;综上所述,本题答案是:C4H8O2 。
(4)结合以上分析可知,乙偶姻的结构简式为: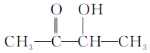 ;综上所述,本题答案是:
;综上所述,本题答案是: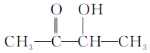 。
。


科目:高中化学 来源: 题型:
【题目】不能用于判断HA是弱电解质(弱酸)的依据是
A. 浓度相等的HCl与HA两溶液,比较c(H+) :HCl约是HA的100倍
B. pH相等的HCl与HA两溶液,c(HA)约是c(HCl)的100倍
C. 浓度相等的HCl与HA两溶液体积相同时,跟镁反应生成氢气HA比HCl多
D. pH相等的HCl与HA两溶液体积相同时,跟镁反应生成氢气HA比HCl多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2A2(g)+B2(g)![]() 2C3(g);△H=-Q1 kJ/mol(Q1>0), 在一个有催化剂的容积不变的密闭容器中加入2 molA2和1 molB2,在500℃时充分反应,达平衡后C3的浓度为w mol·L-1,放出热量为Q2 kJ。
2C3(g);△H=-Q1 kJ/mol(Q1>0), 在一个有催化剂的容积不变的密闭容器中加入2 molA2和1 molB2,在500℃时充分反应,达平衡后C3的浓度为w mol·L-1,放出热量为Q2 kJ。
(1)达到平衡时, A2的转化率为____________。(用Q1 、Q2表示)
(2)达到平衡后,若向原容器中通入少量的氩气,A2的转化率将________(填“增大“、“减小”或“不变”)
(3)若在原来的容器中,只加入2mol C3 ,500℃时充分反应达平衡后,吸收热量Q3 kJ,则Q1、Q2、Q3 之间满足何种关系:Q3=____________。
(4)能说明该反应已经达到平衡状态的是_______
A.v(C3)=2v(B2) B.容器内压强保持不变
C.A2 与 B2 的转化率相等 D.容器内的气体密度保持不变
(5)改变某一条件,得到如图所示的变化规律(图中T表示温度,n表示物质的量),可得出的结论正确的是____________(填序号)

A.反应速率:c>b>a B.达到平衡时A2的转化率大小为:b>a>c
C.T2>T1
(6)若将上述容器改为恒压容容器,起始时加入2 molA2和1 molB2,500℃时充分反应达平衡后,放出热量Q4 kJ,则Q2__________Q4(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁铵[(NH4)2Fe(SO4)2]是分析化学中的重要试剂,在不同温度下加热分解产物不同。设计如图实验装置(夹持装置略去),在500℃时隔绝空气加热A中的硫酸亚铁铵至分解完全,确定分解产物的成分(C、D中溶液成份均过量)。

(1)B装置的作用是______________________________________。
(2)实验中,观察到C中无明显现象,D中有白色沉淀生成,可确定产物中一定有__________气体产生,写出D中发生反应的离子方程式___________________________________。若去掉C,是否能得出同样结论并解释其原因__________________________。
(3)A中固体完全分解后变为红棕色粉末,某同学设计实验验证固体残留物仅为Fe2O3,而不含FeO,请完成表中内容。(试剂,仪器和用品自选)
实验步骤 | 预期现象 | 结论 |
取少量A中残留物于试管中,加入适量稀硫酸,充分振荡使其完全溶解,平均分成2份;_____ | _________________________ | 固体残留物仅为Fe2O3 |
(4)若E中收集到的气体只有N2,其物质的量为x mol,固体残留物Fe2O3的物质的量为y mol,D中沉淀物质的量为z mol,根据氧化还原反应的基本规律,x、y和z应满足的关系为___________。
(5)结合上述实验现象和相关数据的分析,完成硫酸亚铁铵[(NH4)2Fe(SO4)2]在500℃时隔绝空气加热完全分解的化学方程式_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烧碱样品含有少量不与酸作用的杂质,为了测定其纯度,进行以下滴定操作:
A. 在250 mL的容量瓶中定容配制250 mL烧碱溶液;
B. 用碱式滴定管移取25.00 mL烧碱溶液于锥形瓶中并滴入2滴甲基橙指示剂;
C. 在天平上准确称取烧碱样品2.0 g,在烧杯中用蒸馏水溶解;
D. 将物质的量浓度为0.100 0 mol·L-1的标准盐酸装入酸式滴定管,调整液面记下开始读数为V1;
E. 在锥形瓶下垫一张白纸,滴定至终点,记下读数V2。
就此实验完成下列填空:
(1)正确的操作步骤的顺序是(用编号字母填写)
________→________→________→D→________。
(2)上述E中锥形瓶下垫一张白纸的作用是_______________________________
(3)用标准的盐酸滴定待测的NaOH溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视______________。直到加入一滴盐酸后,溶液____________________________ (填颜色变化)。
(4)下列操作中可能使所测NaOH溶液的浓度数值偏低的是(____________)
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
(5)若滴定开始和结束时,酸式滴定管中的液面如图所示,则所用盐酸溶液的体积为________mL。

(6)某学生根据3次实验分别记录有关数据如表:
滴定 次数 | 待测NaOH溶液的体积/mL | 0.100 0 mol·L-1盐酸的体积/mL | ||
滴定前 刻度 | 滴定后刻度 | 溶液体积/mL | ||
第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
依据上表数据列式计算该烧碱的纯度____。(结果保留四位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组欲探究氯气的化学性质,设计如图所示的实验装置。

已知:该装置气密性良好;铜粉放在耐高温托盘内(防止硬质玻璃管炸裂)。
请回答下列问题:
(1)为防止铜与空气中的氧气反应,在加热之前应该进行的操作为____。
(2)当观察到AgNO3溶液中出现白色沉淀时,点燃酒精灯加热;写出AgNO3溶液中生成白色沉淀的化学方程式:____。
(3)硬质玻璃管中的反应现象为__,反应的化学方程式为___。
(4)装置中空试管的作用是____。
(5)烧杯中氢氧化钠溶液的作用是___,发生反应的化学方程式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,表中的数字表示一种短周期元素,回答下列问题:

(1)画出③的原子结构示意图:____________________。
(2)③、④、⑦、⑧四种元素所形成的气态氢化物中最稳定的是__________(填化学式)。
(3)①在元素周期表中的位置是____________________________。
(4)⑧、⑨元素的最高价氧化物对应水化物的酸性:____>____(用化学式表示)。_________
(5)由③、⑤和⑩组成的化合物所含化学键类型为__________,电子式为____________。
(6)④、⑤、⑥的原子半径由大到小的顺序是:____>____>____(用元素符号表示)。__________
(7)⑥单质与氢氧化钠溶液反应的化学方程式是__________________________________。
(8)已知化合物A、B、C、D、E、F、G和单质甲、乙所含元素均为上表中元素组成。
①A的浓溶液与甲能发生如下图所示的反应。
②甲是常见的黑色固体单质,可为生产生活提供热能。
③乙是常见的无色气体单质。
④B是无色有刺激性气味的气体,是主要的大气污染物之一。
⑤常温下,C是一种无色液体。

回答问题:
①写出下列物质的化学式:A_____,E_____,G_____。
②写出下列反应的化学方程式:
C+E→F+乙________________________________。
B+C+乙→A________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com