
【题目】氮氧化物是形成光化学烟雾和酸雨的重要原因。人们研究了诸多有关氮氧化物的性质,请回答下列问题:
(1)处理NOx的一种方法是利用甲烷催化还原NOx。
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) K1
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) K2
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) K3
K1、K2、K3依次为三个反应的平衡常数,则K3=__(用K1、K2表示)。
(2)在恒容密闭容器中通入等物质的量的CO和NO,在一定条件下发生反应:2CO(g)+2NO(g)![]() N2(g)+2CO2(g),测得NO的平衡转化率与温度及压强的关系如图所示:
N2(g)+2CO2(g),测得NO的平衡转化率与温度及压强的关系如图所示:
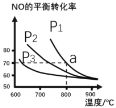
①对于气相反应,用某组分(B)的平衡分压强p(B)代替物质的量浓度c(B)也可表示平衡常数kp,如果p1=1.65MPa,求a点的平衡常数kp=__(MPa)1(结果保留3位有效数字,分压=总压×物质的量分数)。
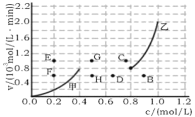
②为探究速率与浓度的关系,该实验中,根据相关实验数据,粗略绘制了2条速率—浓度关系曲线:v正~c(NO)和v逆~c(CO2)则:与曲线v正~c(NO)相对应的是图中曲线__(填“甲”或“乙”)。当降低反应体系的温度,反应一段时间后,重新达到平衡,v正和v逆相应的平衡点分别为___(填字母)。
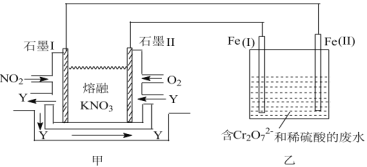
(3)利用电化学原理,将NO2、O2和熔融的KNO3制成燃料电池,模拟工业电解法来处理含Cr2O72的废水,如图所示;电解过程中溶液发生反应:Cr2O72+6Fe2++14H+=2Cr3++6Fe3++7H2O。甲电池工作时,Y是气体,可循环使用。则石墨I附近发生的电极反应式为___。
(4)已知H3PO4为三元酸,Ka1=7.0×103mol·L1,Ka2=6.2×108mol·L1,Ka3=4.5×1013mol·L1。则Na2HPO4水溶液呈__。
【答案】![]() 21.2 乙 D、H NO2+NO3--e-=N2O5 碱
21.2 乙 D、H NO2+NO3--e-=N2O5 碱
【解析】
(1)对已知热化学方程式编号,依据已知的热化学方程式利用盖斯定律构造CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g),然后根据关系式得到平衡常数的关系;
(2)①对于气相反应,用某组分(B)的平衡压强p(B)代替物质的量浓度c(B)也可表示平衡常数(记作Kp),平衡常数等于生成物平衡分压幂次方乘积除以反应物平衡分压幂次方乘积得到,结合化学平衡三段式列式计算,设体积为1L,a点NO转化率为70%,据此计算;
②由三段式得的物质的物质的量分数,带入公式计算可得;
③NO是反应物,CO2是生成物,随反应进行,NO浓度减小,CO2浓度增大,降低反应体系的温度,v正~c(NO)和v逆~c(CO2)均减小,该反应为放热反应,平衡向正反应方向移动;
(3)由题给示意图可知,甲电池工作时,通入二氧化氮的一极为燃料电池的负极;
(4)根据Na2HPO4的电离常数和水解常数的相对大小判断Na2HPO4在水溶液的酸碱性。
(1)①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) K1
②CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) K2
③CH4(g)+4NO(g)=2N2 (g)+CO2(g)+2H2O(g) K3
由盖斯定律得到②![]() 2-①可得③,故对应的三个反应的平衡常数K1、K2、K3之间的关系为:K3=
2-①可得③,故对应的三个反应的平衡常数K1、K2、K3之间的关系为:K3=![]() ;
;
(2)①根据上述分析可知,
平衡气体总物质的量=0.3 mol +0.3 mol +0.35 mol +0.7 mol=1.65mol,因该反应的平衡常数的表达式Kp=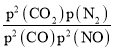 ,若P1=1.65MPa,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,则a点的平衡常数kp=
,若P1=1.65MPa,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,则a点的平衡常数kp=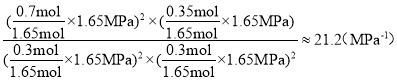 ,故答案为:21.2;
,故答案为:21.2;
③NO是反应物,CO2是生成物,随反应进行,NO浓度减小,CO2浓度增大,则由图可知,与曲线v正~c(NO)相对应的是图中曲线乙;降低反应体系的温度,v正~c(NO)和v逆~c(CO2)均减小,该反应为放热反应,平衡向正反应方向移动,c(NO)减小、c(CO2)增大,则v正和v逆相应的平衡点分别为D和H,故答案为:乙;D、H;
(3)由题给示意图可知,甲电池工作时,通入二氧化氮的一极为燃料电池的负极,二氧化氮在负极失电子发生氧化反应生成五氧化二氮,电极反应式为NO2+NO3--e-=N2O5;
(4)Na2HPO4在水溶液中发生水解反应,水解平衡为HPO42—+H2O![]() H2PO4—+OH—,水解平衡常数
H2PO4—+OH—,水解平衡常数![]() =
=![]() =
=![]() =1.6×10—7>Ka3=4.5×1013,HPO42-的水解程度大于电离程度,故溶液显碱性,故答案为:碱。
=1.6×10—7>Ka3=4.5×1013,HPO42-的水解程度大于电离程度,故溶液显碱性,故答案为:碱。


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:
【题目】在一定条件下,下列物质不能与二氧化硅反应的是( )
①焦炭 ②纯碱 ③碳酸钙 ④氢氟酸 ⑤高氯酸 ⑥氢氧化钾 ⑦氧化钙⑧ 氮气
A.③⑤⑦⑧B.⑤⑦⑧C.⑤⑧D.⑤⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在 2L 容器中发生 A 、B 两种物之间的转化反应 ,A、B 物质的量随时间变化的曲线如图所示,下列说法正确的是
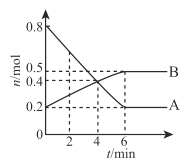
A.该反应的化学方程式是A![]() 2B
2B
B.2 min 时,正反应速率大于逆反应速率
C.4 min 时,A 、B 的物质的量相等且反应达到了平衡状态
D.反应开始至 6min,A 的平均反应速率为0. lmol/(Lmin)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置闭合电键K时,电流计A的指针将发生偏转。试回答:

(1) 丙池是____________(填“原电池”或“电解池”),甲中a极电极名称是________________,丙中c极电极名称是_____________________;
(2)乙中Cu极的电极反应式是__________,若电路中有0.02mol电子通过,则甲中a电极溶解的质量为__________g;
(3)闭合电键K一段时间后,丙池中生成两种气体和一种碱,则丙池中发生的总的化学方程式是_________________;
(4)丙池中反应进行较长时间后,收集到标准状况下氢气2.24L,此时测得丙池溶液质量实际减少4.23 g,含有碱0.100mol(不考虑气体在水中的溶解),则实际放出气体的物质的量是______________mol;
(5)如果要给丙中铁片上镀上一层Cu,则丙池应作何改进_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能表示H2(g)+ I2(g)![]() 2HI(g)已经达到平衡状态的标志有几个( )
2HI(g)已经达到平衡状态的标志有几个( )
①c(H2)=c(I2)=c(HI)时②c(H2):c(I2):c(HI)=1:1:2时③c(H2)、c(I2)、c(HI)不再随时间而改变④单位时间内生成nmolH2的同时生成2nmolHI⑤单位时间内生成n mol H2的同时生成n mol I2⑥反应速v(H2)=v(I2)=1/2v(HI)⑦一个H-H键断裂的同时有两个H-I键断裂⑧温度和体积一定时,容器内压强不再变化⑨温度和体积一定时,混合气体的颜色不再变化⑩温度和压强一定时,混合气体的密度不再变化条件一定,混合气体的平均相对分子质量不再变化
A. 3B. 4C. 5D. 6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由于碳碳双键(![]() )中的π键不能自由旋转,因此
)中的π键不能自由旋转,因此 ![]() 和
和 是两种不同的化合物,互为顺反异构体。则分子式为C3H4Cl2的化合物的烯类异构体有
是两种不同的化合物,互为顺反异构体。则分子式为C3H4Cl2的化合物的烯类异构体有
A. 5种B. 6种C. 7种D. 8种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有NH3、CO、Na、Na2O2、Fe、NO、NO2、F2、SO2等中学化学教材中出现过的物质,根据它们的组成及性质进行如下分类。
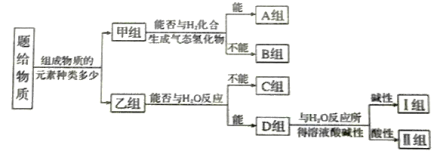
请回答下列问题:
(1)SO2属于_______________(填“酸性氧化物”、“碱性氧化物”、“两性氧化物”)。
(2)Na2O2最终位于________组;它的电子式为____________。
(3)C组有一种气体常用作工业上冶炼铁的还原剂,写出高温下它还原Fe2O3的化学方程式:__________________________。
(4)II组的某种物质能与水发生氧化还原反应,该反应中被氧化与被还原的元素的质量比为_____________。
(5)B组中有一种物质在高温下能与水蒸气反应,若该反应过程中有0.8NA个电子转移则有_________g该物质参与反应。
(6)N2H4是一种高能燃料,有强还原性,可通过I组的某种物质和NaClO反应制得,该制备反应的化学方程式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为长式周期表的一部分其中的编号代表对应的元素.
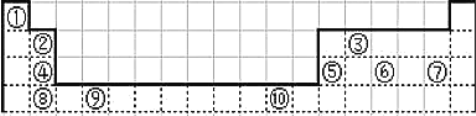
请回答下列问题:
(1)表中属于 ds 区的元素是___________(填元素符号)它的基态原子的价电子排布式为___________。
(2)表中元素①的 6 个原子与元素③的 6 个原子形成的某种平面环状分子其分子式为____________,其中元素③的基态原子轨道表达式为___________;①和⑥形成的一种常见四原子分子的化学式为___________,它是 _________________(填“极性”、“非极性”)分子。
(3)某元素原子的价电子排布式为 nsnnpn+1,该元素原子的电子层上未成对电子数为___________;该元素与元素①形成的最简单分子 X 的电子式为___________。
(4)元素⑤的电负性___________④元素的电负性(选填>、=、<下同);元素⑥的第一电离能___________原子序数为 16 的元素的第一电离能。
(5)用电子式表示元素④和⑦组成的化合物的形成过程________________________。
(6)上表中元素⑤的氢氧化物为两性氢氧化物,请写出元素⑤的氢氧化物与NaOH溶液反应的化学方程式:_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把2mol/L CuCl2溶液和2mol/L盐酸等体积混合(假设混合后溶液体积等于混合前两种溶液的体积之和)。请计算:
(1)混合液中CuCl2和盐酸的物质的量浓度;_______________
(2)混合液中H+、Cu2+、Cl-的物质的量浓度;______________
(3)向溶液中加入足量的铁粉,经足够长的时间后,铁粉有剩余。此时溶液中FeCl2的物质的量浓度。____________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com