
【题目】根据实验室测定硫酸铜晶体结晶水含量的实验,填写下列空白:
(1)从下列仪器中选出所需仪器(用标号字母填写)_____;
A.电子天平 B.研钵 C.药匙 D.酒精灯 E.干燥器 F.玻璃棒 G.石棉网 H.蒸发皿 I.坩埚 J.三脚架
除上述仪器外,还需要的仪器是____;
(2)某学生实验后得到以下数据:
加热前的质量(g) | 加热前的质量(g) | ||
W1(容器) | W2(容器+晶体) | W3(容器+无水硫酸铜) | |
第一次 | 15.688 | 17.668 | 16.962 |
第一次 | 15.688 | 17.744 | 17.002 |
请写出结晶水x=___(保留2位小数),实验误差=_____%(保留2位小数);
从下列选项中选出该学生产生误差的原因可能是(填写字母)____。
A.加热前称量时容器未完全干燥 B.晶体表面已经少量失水
C.加热后容器未放入干燥器中冷却 D.加热过程中晶体有少量溅失
【答案】ABCDEFGIJ 坩埚钳、泥三角 4.97 -0.6 BC
【解析】
(1)首先根据实验步骤中的各步操作,确定所需的实验仪器;
(2)根据结晶水合物中,结晶水的质量=m(容器十晶体)-m(容器十无水硫酸铜),据化学方程式可以计算结晶水x的值,在测定中若被测样品中含有加热挥发的杂质或实验前容器中有水,都会造成测量结果偏高、偏低。
(1)测定硫酸铜晶体(CuSO45H2O)里结晶水的含量,实验步骤为:①研磨、②称量空坩埚和装有试样的坩埚的质量、③加热、④冷却、⑤称量、⑥重复③至⑤的操作,直到连续两次称量的质量差不超过0.1g为止、⑦根据实验数据计算硫酸铜结晶水的含量;所需仪器是托盘天平、研钵、酒精灯、玻璃棒、坩埚、干燥器、泥三角、三角架、药匙、坩埚钳,则所需仪器为ABCDEFIJ;还需要:泥三角、坩埚钳;
(2)由表格中的数据,第一次酸硫铜的质量为16.962g-15.688g=1.274g,水的质量:17.668g-16.962g=0.706g,第二次酸硫铜的质量为:17.002g-15.688g=1.314g,水的质量:17.744g-17.002g=0.742g,
则CuSO 4xH2O![]() CuSO 4 + xH2O,
CuSO 4 + xH2O,
160 18x
1.274g 0.706g
![]() =
=![]() ,解得x≈4.93;
,解得x≈4.93;
CuSO 4.xH2O![]() CuSO 4+xH2O
CuSO 4+xH2O
160 18x
1.314g 0.742g
![]() =
=![]() ,解得x≈5.01,两次的平均值x=
,解得x≈5.01,两次的平均值x=![]() =4.97;实验误差=
=4.97;实验误差=![]() ×100%≈-0.6%;
×100%≈-0.6%;
A.加热前所用的容器未完全干燥.加热后水挥发,导致水的质量测定结果偏大,故A错误;
B.晶体表面已经少量失水,会导致水测定结果偏小,故B正确;
C.加热后容器未放入干燥器中冷却会导致测定的水的质量偏小,故C正确;
D.加热过程中晶体有少量溅失会导致测定的水的质量偏大,故D错误;
故答案为BC。


科目:高中化学 来源: 题型:
【题目】NA是阿伏加德罗常数的值,下列说法正确的是( )
A.1 mol Na与O2完全反应生成Na2O和Na2O2的混合物,转移电子数为NA,生成物中离子总数为2NA
B.![]() 的NaHSO3溶液中,由水电离的H+数目为0.01NA个
的NaHSO3溶液中,由水电离的H+数目为0.01NA个
C.32.5 g锌与一定量浓硫酸恰好完全反应,生成气体的分子数为0.5NA
D.反应3H2(g)+N2(g)![]() 2NH3(g) ΔH=-92 kJ·mol-1,当放出热量9.2 kJ时转移电子0.3NA
2NH3(g) ΔH=-92 kJ·mol-1,当放出热量9.2 kJ时转移电子0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上通常利用SiO2 和碳反应来制取硅,写出反应的化学方程式___________________。
工业上还可以利用镁制取硅,反应为2Mg+SiO2 = 2MgO+Si,同时会发生副反应:2Mg + Si = Mg2Si。如图是进行Mg与SiO2反应的实验装置,试回答下列问题:

(1)由于O2和H2O(g)的存在对该实验有较大影响,实验中应通入气体X作为保护气,试管中的固体药品可选用________(填序号)。
a.石灰石 b.锌粒 c.纯碱
(2)实验开始时,必须先通一段时间X气体,再加热反应物,其理由是 ___________________________;当反应引发后,移走酒精灯,反应能继续进行,其原因是______________________。
(3)反应结束后,待冷却至常温时,往反应后的混合物中加入稀盐酸,可观察到闪亮的火星,产生此现象的原因是副产物Mg2Si遇盐酸迅速反应生成SiH4(硅烷)气体,然后SiH4自燃.用化学方程式表示这两个反应①________________________②___________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物X、Y均具有抗真菌、抗炎、植物毒性及细胞毒性等功能。下列有关化合物X、Y的说法正确的是( )
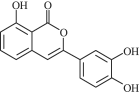 化合物X
化合物X 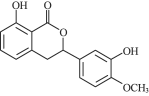 化合物Y
化合物Y
A.X、Y属于同系物
B.![]() 最多能与
最多能与![]() 发生取代反应
发生取代反应
C.Y在酸性条件下水解,水解产物可发生消去反应
D.X、Y分别与足量![]() 加成的产物分子中手性碳原子数目相等
加成的产物分子中手性碳原子数目相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸(H2C2O4)是一种重要的化学试剂。下面是利用草酸探究外界条件对反应速率影响的实验。
(1)该反应是溶液之间发生的不可逆反应,改变压强对其反应速率的影响是___(填序号)。
A.可能明显加快 B.可能明显减慢 C.几乎无影响,可以忽略
(2)用酸性KMnO4和H2C2O4反应研究影响反应速率的因素。一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化):
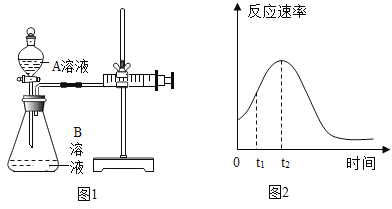
实验序号 | A溶液 | B溶液 |
① | 20mL0.1molL-1H2C2O4溶液 | 30mL0.01molL-1KMnO4溶液 |
② | 20mL0.2molL-1H2C2O4溶液 | 30mL0.01molL-1KMnO4溶液 |
①该反应的离子方程式____。
②该实验探究的是___因素对化学反应速率的影响。相同时间内针筒中所得CO2的体积大小关系是___>__(填实验序号)。
(3)若实验①在2min末收集了4.48mLCO2(标准状况下),用CO2表示2min内的反应速率为___mol/min,则在2min末c(MnO4-)=___mol/L(假设混合液体积为50mL)。
(4)小组同学发现反应速率总是如图2,其中t1~t2时间内速率变快的主要原因可能是:①____;②____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化铝(AlN,Al和N的相对原子质量分别为27和14)广泛用于电子、陶瓷等工业领域。在一定条件下,AlN可通过反应Al2O3+N2+3C![]() 2AlN+3CO合成。下列叙述正确的是( )
2AlN+3CO合成。下列叙述正确的是( )
A.上述反应中,N2是还原剂,Al2O3是氧化剂
B.上述反应中,每生成1mol AlN需转移3mol电子
C.AlN中氮元素的化合价为+3
D.AlN的摩尔质量为41g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H是合成一种新型抗肿瘤药物的中间体,其合成路线如下:
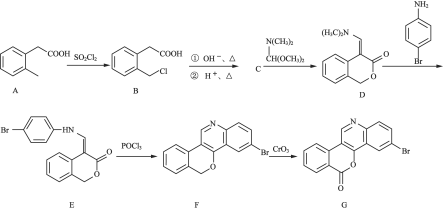
(1)B中的官能团名称为________(写两种)。
(2)![]() 的反应类型为________。
的反应类型为________。
(3)C的分子式为![]() ,写出C的结构简式:________________。
,写出C的结构简式:________________。
(4)D的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:________________。
①分子中含有苯环,碱性水解后酸化,一种产物分子是最简单的![]() 氨基酸。
氨基酸。
②分子中有5种不同化学环境的氢。
(5)已知:R-Cl+R’-OH![]() R-R’
R-R’
请写出以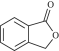 和
和![]() 为原料制备
为原料制备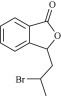 的合成路线流程图_____________(无机试剂任用,合成路线流程图示例见本题题干)。
的合成路线流程图_____________(无机试剂任用,合成路线流程图示例见本题题干)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温条件下,向盛有食盐的2L恒容密闭容器中加入0.2molNO2、0.2molNO和0.1molCl2,发生如下两个反应:
①2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g) △H1<0平衡常数K1
NaNO3(s)+ClNO(g) △H1<0平衡常数K1
②2NO(g)+Cl2(g)![]() 2ClNO(g) △H2<0 平衡常数K2
2ClNO(g) △H2<0 平衡常数K2
10分钟时反应达到平衡,测得容器内体系的压强减少20%,10分钟内用ClNO(g)表示的平均反应速率v(ClNO)=7.5×10-3mol/(Lmin)。下列说法不正确的是( )
A.反应4NO2(g)+2NaCl(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g) 的平衡常数为
2NaNO3(s)+2NO(g)+Cl2(g) 的平衡常数为![]()
B.平衡后c(Cl2)=2.5×10-2mol/L
C.其它条件保持不变,反应在恒压条件下进行,则平衡常数K2增大
D.平衡时NO2的转化率为50%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)观察下列A、B、C、D、E五种粒子(原子或离子)的结构示意图,回答有关问题。
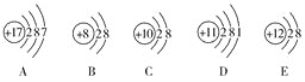
①与离子相对应的元素符号是______________,与原子相对应的离子的结构示意图是______________。
②电子层结构相同的是__________(填写代号,下同),性质最稳定的是__________,最容易失去电子的是__________,最容易得到电子的是__________。
③可直接相互结合形成的化合物的化学式是____________。可经过得失电子后再相互结合形成的化合物的化学式是______________。
④在核电荷数1~10的元素内,列举两个与B电子层结构相同的离子,写出离子的符号______________。
(2)已知元素X和Y的核电荷数均小于18,最外层电子数分别为n和(m-5),次外层有(n+2)个和m个电子,据此推断元素X和Y,其名称为X__________,Y__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com