

| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量/mG | 255 | 385 | 459 |
| 气体休积/mL | 280 | 336 | 336 |
| 0.336L |
| 22.4L/mol |
| 0.03mol |
| 0.03L |
| 0.28L |
| 22.4L/mol |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
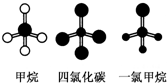
| A、CH4、CCl4和CH3Cl都是正四面体结构 |
| B、CH4、CCl4都是正四面体结构 |
| C、CH4和CCl4中的化学键完全相同 |
| D、CH4、CCl4的结构相同,性质也相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、x≥1.5 | B、x=1.5 |
| C、x≤1.5 | D、无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、难氧化,易加成,难取代 |
| B、易取代,能加成,难氧化 |
| C、易氧化,易加成,难取代 |
| D、因是单双键交替结构,故易加成为环己烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 |
B、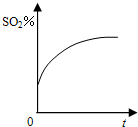 |
C、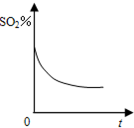 |
D、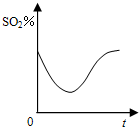 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、物 质的化学反应与体系的能量变化不是同时发生的 |
| B、化学键可以使离子相结合,不可以使原子相结合 |
| C、在相同的温度和压强下,等体积的O2和O3含有相同数目的原子 |
| D、金属元素和非金属元素分界线附近的元素多用于制造半导体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com