
【题目】能增加反应物分子中活化分子的百分数的是( )
A.降低温度 B.增大压强 C.使用催化剂 D.增加浓度
科目:高中化学 来源: 题型:
【题目】元素铬及其化合物工业用途广泛,但含+6价铬的污水会损害环境。电镀厂产生的镀铜废水中往往含有一定量的Cr2O72-,处理该废水常用直接沉淀法、还原沉淀法、电解法。
I.直接沉淀法
(1)已知含铬废水中存在着平衡:![]() 。在实际工业生产中,加入沉淀剂BaCl2溶液之前还要加入一定量的NaOH,这样有利于沉淀的生成,则生成沉淀的化学式为
。在实际工业生产中,加入沉淀剂BaCl2溶液之前还要加入一定量的NaOH,这样有利于沉淀的生成,则生成沉淀的化学式为
Ⅱ.还原沉淀法
![]()
(2)下列溶液中可以代替上述流程中Na2S2O3溶液的是 (填选项序号)
A.FeSO4溶液 B.浓H2SO4溶液
C.酸性KMnO4溶液 D.Na2SO3溶液
(3)上述流程中,每消耗0.1molNa2S2O3转移0.8mole-,则加入Na2S2O3溶液时发送反应的离子方程式为
(4)Cr(OH)3的化学性质与Al(OH)3相似。在上述生产过程中加入NaOH溶液时要控制溶液的pH不能过高,原因可用离子方程式表示:
(5)实际工业生产中有时还采用阳离子交换树脂法来测定沉淀后溶液中Cr3+的含量,其原理是Mn++nNaR=nNa++MRn,其中NaR为阳离子交换树脂,Mn+为要测定的离子。
常温下,某次测定过程中,将pH=5的废水经过阳离子交换树脂后,测的溶液中Na+比交换前增加了4.6×10-2g/L,则该条件下Cr(OH)3的Ksp的值为 ,当Cr3+浓度小于10-5mol/L时可认为沉淀完全,处理后测得溶液的PH=6,则溶液过滤后 (填“能”或“否”)直接排放
Ⅲ.电解法
(6)该法是用铁作电极点解含Cr2O72-的酸性废水,电解时阴极上有大量气泡生成,并产生Cr(OH)3、Fe(OH)3沉淀,反应中1mol Cr2O72-完全生成Cr(OH)3沉淀,外电路通过的电子的物质的量为 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)甲醇(CH3OH)是重要的溶剂和替代燃料,工业上用CO和H2在一定条件下制备CH3OH的反应为:CO(g)+2H2(g)![]() CH3OH(g),在体积为1L的恒容密闭容器中,充入2molCO和4molH2,一定条件下发生上述反应,测得CO(g)和CH3OH(g)的浓度随时间变化如图一所示。
CH3OH(g),在体积为1L的恒容密闭容器中,充入2molCO和4molH2,一定条件下发生上述反应,测得CO(g)和CH3OH(g)的浓度随时间变化如图一所示。
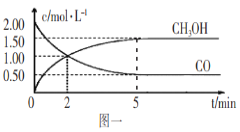
①从反应开始到l0min,用一氧化碳表示的平均反应速率v(CO)=____________。
②下列说法正确的是____________(填字母序号)。
A.达到平衡时,H2的转化率为65%
B.5min后容器中混合气体的平均相对分子质量不再改变
C.达到平衡后,再充入氩气,反应速率减小
D.2min前v(正)>v(逆),2min后v(正)<v(逆)
(2)碳与水蒸气反应制取H2的相关反应如下:
Ⅰ:C(s)+H2O(g)=CO(g)+H2(g) △H=+131.0kJ/mol
Ⅱ:CO(g)+H2O(g)=CO2(g)+H2(g) △H= - 43kJ/mol
Ⅲ:CaO(s)+CO2(g)=CaCO3(S) △H= - 178.3kJ/mol
计算反应C(s)+2H2O(g)+CaO(s)![]() CaCO3(s)+2H2(g)的△H=__________kJ/mol;
CaCO3(s)+2H2(g)的△H=__________kJ/mol;
若K1、K2、K3分别为反应Ⅰ、Ⅱ、Ⅲ的平衡常数,该平衡常数K=__________(用K1、K2、K3表示)。
②对于可逆反应C(s)+2H2O(g)+CaO(s)![]() CaCO3(s)+2H2(g),采取以下措施可以提高H2产率的是________。(填字母)
CaCO3(s)+2H2(g),采取以下措施可以提高H2产率的是________。(填字母)
A.降低体系的温度 B.压缩容器的体积
C.增加CaO的量 D.选用适当的催化剂
(3)甲醇作为一种燃料还可用于燃料电池。在温度为650℃的熔融盐燃料电池中用甲醇、空气与CO2的混合气体作反应物,镍作电极,用Li2CO3和Na2CO3混合物作电解质。该电池的负极反应式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作或处理事故的方法正确的是( )
A. 用分液漏斗分离乙酸乙酯和水的混合物时,水从下口放出,乙酸乙酯从上口倒出
B. 在耐高温的石英坩埚中进行熔化氢氧化钠固体的实验
C. 用干燥的pH试纸测定NaClO溶液的pH
D. 欲配制质量分数为10%的硫酸铜溶液,可准确称取10 g硫酸铜晶体溶于90 g水中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁与一定浓度的稀硝酸反应时,硝酸的还原产物为NH4NO3。现将一定量的镁粉投入200 ml 稀硝酸中,两者恰好完全反应。若向反应后的溶液中加入过量的浓NaOH溶液并微热,溶液中有白色沉淀生成,同时有氨气逸出,且逸出的氨气干燥后全部被稀硫酸吸收,稀硫酸增重0.17g 。试回答下列问题:
(1)根据上述信息写出Mg和硝酸反应的化学方程式:____________________。
(2)发生还原反应的硝酸的物质的量为________mol。
(3)参加反应的镁的质量为_________g。
(4)原稀硝酸的物质的量浓度为_________mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用铂电极惰性电解下列溶液时,阴极和阳极上的主要产物分别是H2和O2的是( )
A 稀NaOH溶液 B HCl溶液 C NaCl溶液 D 酸性AgNO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用所学知识,回答下列问题。
I、向硫酸铜溶液中逐滴加入KI溶液至恰好反应完全,观察到产生白色沉淀CuI,蓝色溶液变为棕色。该反应的离子方程式为__________;取一定量上述反应后的上层棕色清液于一支试管中,加入一定量的苯,振荡,此时观察到的现象是________。
II、工业上用铝土矿(主要成分为Al2O3,只含Fe2O3杂质)为原料冶炼铝的工艺流程如下:
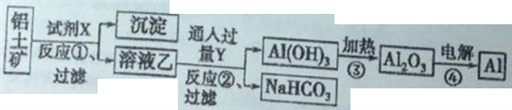
回答下列问题:
(1)上述反应是否都是氧化还原反应_________(填“是”或“否”);写出反应①的化学方程式_____。
(2)反应①后过滤的沉淀为_______,简述确定此物质中金属元素及其价态的操作过程_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用硫铁矿石(主要成分FeS2)在沸腾炉中焙烧,经过一系列反应,得到硫酸,焙烧后的矿渣用于炼铁。其转化过程如下图所示(部分条件、反应物和产物已略去):
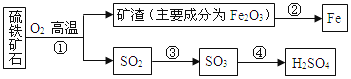
请回答下列问题:
(1)在上面转化过程中,硫元素被氧化的反应是________(填反应编号)。
(2)写出反应②中炼铁的化学方程式_____________。若用1000t含杂质28%的矿渣炼铁,理论上可得到含铁96%的生铁质量为_____________ t.
(3)写出反应①的化学方程式 ,若有12.0g FeS2参加反应,则发生转移的电子数为 。
(4)烟气中SO2的排放会造成酸雨,工业上常用Na2SO3溶液来吸收SO2以减少对环境的危害。
①常温下,将SO2通入一定体积的1.0mol·L-1Na2SO3溶液中,溶液pH不断减小。当溶液pH约为6时,吸收SO2的能力显著下降,此时溶液中c(SO32-)的浓度是0.2mol·L-1,则溶液中c(HSO3-)是 mol·L-1。用化学平衡原理解释此时溶液显酸性的原因 。
②向①中pH约为6时的吸收液中通入足量O2充分反应。取反应后溶液10mL与10mLBaCl2溶液混合,欲使混合时能生成沉淀,所用BaCl2溶液的浓度不得低于 mol·L-1。[已知25℃时,Ksp(BaSO3)=5.48×10-7, Ksp(BaSO4)= 1.08×10-10]
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com