
| J | ||||
| R |
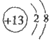 ;
;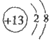 ; 第三周期ⅦA族;
; 第三周期ⅦA族;  ,
, ;
;| 1mol |
| 0.2mol |


科目:高中化学 来源: 题型:

| A、Bi元素的质量数是209 | ||||
B、H
| ||||
C、
| ||||
| D、原子序数为29的元素位于元素周期表的第四周期ⅠB族 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、75 mL 2 mol/L的CaCl2 |
| B、150 mL 3 mol/L的KCl |
| C、150 mL 1 mol/L的NaCl |
| D、75mL 2 mol/L的NH4Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、+184.6kJ?mol-1 |
| B、-92.3kJ?mol-1 |
| C、-369.2kJ?mol-1 |
| D、+92.3kJ?mol- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X的最高化合价为+4 |
| B、X是第三周期VA族元素 |
| C、X是第三周ⅥA族元素 |
| D、X的最高价含氧酸的分子式可表示为H2XO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
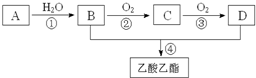 已知:A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平.现以A为主要原料合成乙酸乙酯,其合成路线如图所示.
已知:A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平.现以A为主要原料合成乙酸乙酯,其合成路线如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
| V(HCl)/mL | 0.00 | 12.00 | 18.00 | 22.00 | 23.00 | 23.96 | 24.00 | 24.04 | 25.00 | 26.00 | 30.00 |
| pH | 13.1 | 12.6 | 12.2 | 11.7 | 11.4 | 9.9 | 7.0 | 4.0 | 2.7 | 2.4 | 1.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、气态氢化物稳定性:W<T |
| B、离子半径:X<R |
| C、最高价氧化物对应水化物碱性:X>Y |
| D、Y单质能与冷水剧烈反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com