
【题目】下列离子方程式书写均正确的是( )
A.用Cl2与NaOH溶液反应制漂白液:2OH-+Cl2=2ClO-+H2↑
B.SO2通入FeCl3溶液:2Fe3++SO2+2H2O=2Fe2++![]() +4H+
+4H+
C.向Na2SiO3溶液中滴加稀盐酸:Na2SiO3+2H+=H2SiO3+2Na+
D.H2SO4溶液与Ba(OH)2溶液反应:![]() +Ba2+=BaSO4↓
+Ba2+=BaSO4↓
【答案】B
【解析】
A.氯气和氢氧化钠溶液反应生成NaCl、NaClO和水,漂白液的主要成分是次氯酸钠,反应的离子方程式为Cl2+2OH-=ClO-+Cl-+H2O,故A错误;
B.SO2通入FeCl3溶液中,二氧化硫与铁离子发生氧化还原反应生成亚铁离子、氢离子、硫酸根离子,反应的离子方程式为:2Fe3++SO2+2H2O=2Fe2++![]() +4H+,故B正确;
+4H+,故B正确;
C.向Na2SiO3溶液中滴加稀盐酸,反应生成硅酸沉淀和氯化钠,硅酸钠可以拆成离子形式,正确的离子方程式为:SiO32-+2H+=H2SiO3↓,故C错误;
D.H2SO4溶液与Ba(OH)2溶液反应至中性,氢离子和氢氧根离子都恰好反应,正确的离子方程式为:2H++SO42+Ba2++2OH=BaSO4↓+2H2O,故D错误;
答案选B。


 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:
【题目】氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品。下图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过。完成下列填空:
(1)写出电解饱和食盐水的离子方程式________________。
(2)离子交换膜的作用为____________________。
(3)精制饱和食盐水从图中________位置补充,氢氧化钠溶液从图中________位置流出。(选填“a”、“b”、“c”或“d”)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校课外活动小组为了探究铜与稀硝酸反应产生的是NO气体,设计了如下实验。实验装置如图所示(已知NO、NO2能与NaOH溶液反应):
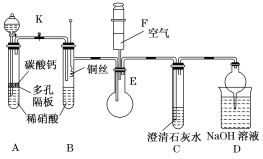
(1)设计装置A的目的是____________________________;
(2)在(1)中的操作后将装置B中铜丝插入稀硝酸,并微热之,观察到装置B中的现象是____________________;B中反应的离子方程式是_______________________。
(3)装置E和F的作用是______________________________。
(4)D装置的作用是___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关硅及硅酸盐材料的说法正确的是( )
A.硅酸钠属于盐,不属于碱,所以硅酸钠可以保存在磨口玻璃塞试剂瓶中
B.反应①Na2SiO3+H2O+CO2═Na2CO3+H2SiO3↓,反应②Na2CO3+SiO2![]() Na2SiO3+CO2↑,两反应是相互矛盾的,不可能都能发生
Na2SiO3+CO2↑,两反应是相互矛盾的,不可能都能发生
C.普通玻璃、石英玻璃、水泥等均属于硅酸盐材料
D.祖母绿的主要成分为Be3Al2Si6O18,用氧化物形式表示为3BeO·Al2O3·6SiO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向甲、乙两个恒容密闭容器中分别充入一定量的SiHCl3,发生反应:2SiHCl3(g)![]() SiH2Cl2(g)+SiCl4(g) ΔH=+48kJ·mol1,维持容器的温度分别为T1℃和T2℃不变,反应过程中SiHCl3的转化率随时间的变化如图所示。下列说法正确的是( )
SiH2Cl2(g)+SiCl4(g) ΔH=+48kJ·mol1,维持容器的温度分别为T1℃和T2℃不变,反应过程中SiHCl3的转化率随时间的变化如图所示。下列说法正确的是( )
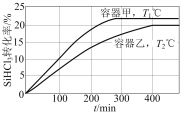
A.T1>T2
B.维持温度不变,向平衡后的乙容器中充入一定量的SiHCl3,平衡不移动
C.T2℃时,反应的平衡常数:K=![]()
D.T1℃时,向甲容器中起始充入0.2molSiHCl3和0.02molSiH2Cl2,SiHCl3的平衡转化率小于10%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下述实验中均有红棕色气体产生,对比分析所得结论不正确的是( )
|
|
|
① | ② | ③ |
A.由①中的红棕色气体,推断产生的气体一定是混合气体
B.红棕色气体不能表明②中木炭与浓硝酸发生了反应
C.由③说明浓硝酸具有挥发性,生成的红棕色气体为还原产物
D.③的气体产物中检测出CO2,由此说明木炭一定与浓硝酸发生了反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】印刷电路板(PCB)是用腐蚀液将覆铜板上的部分铜腐蚀掉而制得。一种用FeCl3溶液制作PCB并将腐蚀后废液回收再生的流程如图:
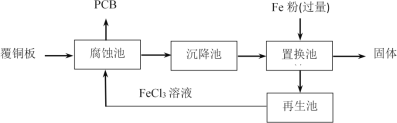
下列说法不正确的是( )
A.腐蚀池中发生反应的化学方程式是:Cu+2FeCl3=CuCl2+2FeCl2
B.腐蚀后的废液中,主要的金属阳离子有Fe3+、Cu2+、Fe2+
C.置换池中发生的主要反应为:Fe+Cu2+=Cu+Fe2+和Fe+2Fe3+=3Fe2+
D.再生池中加入酸化的H2O2,反应过程中pH降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空:
(1)按官能团的不同,可以对有机物进行分类,请写出下列有机物的种类:
① CH3CH2CH2COOH ________; ② ![]() _________;
_________;
③ CH3CH2CHO _____________; ④ ![]() ________________。
________________。
(2)请用系统命名法命名下列有机物:
① CH3C(CH3)2CH2CH3 ________ ②![]() _________ ③
_________ ③  __________
__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸氯(ClNO)是有机合成中的重要试剂。亚硝酸氯可由NO与Cl2在通常条件下反应得到,化学方程式为2NO(g)+Cl2(g)![]() 2ClNO(g)。
2ClNO(g)。
(1)氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酸氯,涉及如下反应:
①4NO2(g)+2NaCl(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g) ΔH1
2NaNO3(s)+2NO(g)+Cl2(g) ΔH1
②2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g) ΔH2
NaNO3(s)+ClNO(g) ΔH2
③2NO(g)+Cl2(g)![]() 2ClNO(g) ΔH3
2ClNO(g) ΔH3
则ΔH1、ΔH2、ΔH3之间的关系为ΔH3=____________。
(2)已知几种化学键的键能数据如表(亚硝酸氯的结构为Cl-N=O,一氧化氮的结构为N≡O)
化学键 | N≡O | Cl-Cl | Cl-N | N=O |
键能/kJ mol-1 | 630 | 243 | a | 607 |
则2NO(g)+Cl2(g)![]() 2ClNO(g)反应的ΔH=_________kJ ·mol-1
2ClNO(g)反应的ΔH=_________kJ ·mol-1
(3)T℃时,2NO(g)+Cl2(g) ![]() 2ClNO(g)的正反应速率表达式为υ正=kcn(ClNO),测得速率和浓度的关系如下表:
2ClNO(g)的正反应速率表达式为υ正=kcn(ClNO),测得速率和浓度的关系如下表:
序号 | c(ClNO)/mol·L-1 | υ/mol·L-1· s-1 |
① | 0.30 | 3.6×10-8 |
② | 0.60 | 1.44×10-7 |
③ | 0.90 | 3.24×10-7 |
n=__________;k=___________(注明单位)。
(4)在2 L的恒容密闭容器中充入4mol NO(g)和2molCl2(g),在不同温度下测得c(ClNO)与时间的关系如图。
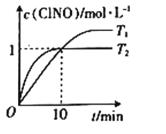
①由图可知T1、T2温度的速率υ1______υ2温度T1______T2。(填>、<或=)
②温度为T1时,能作为该反应达到平衡的标志的有__________。
a.气体体积保持不变 b.容器压强保持不变 c.气体颜色保持不变 d.υ(ClNO)=υ(NO) e.NO与ClNO的物质的量比值保持不变
③反应开始到10min时,Cl2的平均反应速率υ(Cl2)=_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com