
【题目】前四周期A,B,C,D,E,F,G原子序数依次增大,A元素的质子数和质量数相等,B元素具有三个能级且所排电子数相同,D元素2p能级上电子数是2s能级的两倍;D和E相邻且同主族.F是第四周期未成对电子最多的原子,G是目前使用量最多的金属 请回答下列问题:(用推出的元素符号或者化学式作答)
(1)F的价电子排布式为 , B,C,D三种元素的第一电离能从大到小的顺序为 .
(2)BD32﹣中B原子的杂化方式为 , 该离子的空间构型为
(3)写出一种由A,C,D组成且既含离子键又含共价键的物质的化学式 , 化合物ABC中σ键和π键数目之比为 , C的气态氢化物在一定的压强下,测得的密度比该压强下理论密度略大,请解释原因 .
(4)E和G形成的某种晶胞如下图所示:其中白球表示E,黑球表示G.则该物质的化学式为 , 假设该晶胞的密度为ρ g/cm3 , 用NA表示阿伏加德罗常数,则该晶胞中距离最近的G原子之间的距离为cm. 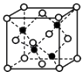
【答案】
(1)3d54s1;N>O>C
(2)sp2杂化;平面正三角形
(3)NH4NO3或者NH4NO2;1:1;NH3通过氢键形成“缔合”分子,导致相对分子质量增大,分子间作用力增强,分子间距离减小,导致密度反常增大
(4)FeS;![]() ×
× ![]()
【解析】解:根据“A元素的质子数和质量数相等”推知A为H(氢);根据“B元素具有三个能级且所排电子数相同”推知B为C(碳);根据“D元素2p能级上电子数是2s能级的两倍”推知D为O(氧);根据“B、C、D原子序数依次增大”推知C为N(氮);根据“D和E相邻且同主族”推知E为S(硫);第四周期中Cr元素的未成对电子高达6个最多,故F为Cr(铬);根据“G是目前使用量最多的金属”推知G为Fe(铁).(1)Cr的价电子排布式是保证3d能级和4s能级都处于半充满状态,更加稳定,故Cr的价电子排布为3d54s1;第一电离能同一周期从左到右呈增大趋势,ⅡA族、Ⅴ族反常,故的原动力N>O>C;所以答案是:3d54s1;N>O>C;(2)CO32﹣中C原子孤电子对数= ![]() =0,价层电子对数=3+0=3,故碳原子杂化方式为sp2杂化,空间构型为平面正三角形,所以答案是:sp2杂化;平面正三角形;(3)铵盐属于离子化合物存在离子键也存在共价键,三种元素形成的铵盐可以是NH4NO3或者NH4NO2;HCN中存在两条σ键和2条π键,二者之比为1:1;NH3通过氢键形成“缔合”分子,导致相对分子质量增大,分子间作用力增强,分子间距离减小,导致密度反常增大,所以答案是:NH4NO3或者NH4NO2;1:1;NH3通过氢键形成“缔合”分子,导致相对分子质量增大,分子间作用力增强,分子间距离减小,导致密度反常增大;(4)黑球铁处于晶胞晶胞,晶胞中含有4个Fe原子,白球S处于顶点和面心,晶胞中含有S原子数目为6×
=0,价层电子对数=3+0=3,故碳原子杂化方式为sp2杂化,空间构型为平面正三角形,所以答案是:sp2杂化;平面正三角形;(3)铵盐属于离子化合物存在离子键也存在共价键,三种元素形成的铵盐可以是NH4NO3或者NH4NO2;HCN中存在两条σ键和2条π键,二者之比为1:1;NH3通过氢键形成“缔合”分子,导致相对分子质量增大,分子间作用力增强,分子间距离减小,导致密度反常增大,所以答案是:NH4NO3或者NH4NO2;1:1;NH3通过氢键形成“缔合”分子,导致相对分子质量增大,分子间作用力增强,分子间距离减小,导致密度反常增大;(4)黑球铁处于晶胞晶胞,晶胞中含有4个Fe原子,白球S处于顶点和面心,晶胞中含有S原子数目为6× ![]() +8×
+8× ![]() =4,约成最简整数比既得化学式为FeS,晶胞质量为4×
=4,约成最简整数比既得化学式为FeS,晶胞质量为4× ![]() g,假设该晶胞的边长为a cm,则(a cm)3×ρ g/cm3=4×
g,假设该晶胞的边长为a cm,则(a cm)3×ρ g/cm3=4× ![]() g,则a=
g,则a= ![]() ,距离最近的S原子之间距离为晶胞边长的
,距离最近的S原子之间距离为晶胞边长的 ![]() ,故S原子之间距离为
,故S原子之间距离为 ![]() ×
× ![]() cm,所以答案是:FeS;
cm,所以答案是:FeS; ![]() ×
× ![]() .
.


科目:高中化学 来源: 题型:
【题目】根据题意解答
(1)某实验小组同学进行如下实验,以检验化学反应中的能量变化,实验中发现,反应后①中的温度升高;②中的温度降低.由此判断铝条与盐酸的反应是热反应,Ba(OH)28H2O与NH4Cl的反应是热反应.反应过程(填“①”或“②”)的能量变化可用图2表示. 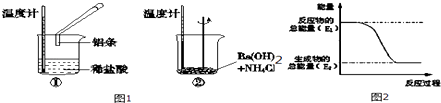
(2)为了验证Fe3+与Cu2+氧化性强弱,下列装置能达到实验目的是(填序号). 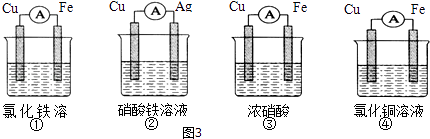
(3)将CH4设计成燃料电池,其利用率更高,装置如图4所示(a、b为多孔碳棒).处电极入口通甲烷(填A或B),其电极反应式为 . 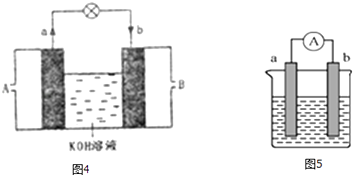
(4)如图5是某化学兴趣小组探究不同条件下化学能转变为电能的装置.请回答下列问题: ①当电极a为Al、电极b为Cu、电解质溶液为稀硫酸时,写出该原电池正极的电极反应式为 .
②当电极a为Al、电极b为Mg、电解质溶液为氢氧化钠溶液时,该原电池的正极为;该原电池的负极反应式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X,Y,Z,W在元素周期表中的相对位置如图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法不正确的是( ) 
A.原子半径:W>Z>Y>X
B.最高价氧化物对应水化物的酸性:X>W>Z
C.最简单气态氢化物的热稳定性:Y>X>W>Z
D.元素X,Z,W的最高化合价分别与其主族序数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列高聚物:A.聚乙烯 B.天然橡 C.硫化橡胶 D.酚醛树脂E.有机玻璃(聚甲基丙烯酸甲酯)
其中属于线型结构的是 , 属于体型结构的是 , 加热可熔融的是 , 用于制备轮胎的是 , 用于制备插座、电器把手的是 , 用于制造车窗玻璃的是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关系正确的是( )
A.熔点:戊烷>2,2一二甲基戊烷>2,3一二甲基丁烷>丙烷
B.密度:CCl4>CHCl3>H2O>苯
C.同质量的物质燃烧耗O2量:丙炔>乙烷>乙烯>乙炔>甲烷
D.同物质的量物质燃烧耗O2量:已烷>环已烷>苯>苯甲酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】XeO3是一种不稳定的物质,具有强氧化性.
(1)配平反应的离子方程式:
XeO3+Mn2++H2O→MnO4﹣+Xe↑+H+
(2)反应现象为:①有气泡产生;② .
(3)被氧化的元素是 .
(4)将适量的XeO3投入30mL 0.1molL﹣1 Mn2+的水溶液中,刚好完全反应.
①此时转移电子总数为 .
②将反应后的溶液稀释至90mL,所得溶液的pH= .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式的书写正确的是( )
A.实验室用大理石和稀盐酸制取CO2:2H++CO ![]() =CO2↑+H2O
=CO2↑+H2O
B.铁和稀硝酸反应:Fe+2H+=H2↑+Fe2+
C.向AlCl3溶液中加入过量的NaOH溶液:Al3++3OH﹣=Al(OH)3↓
D.NaHCO3溶液与NaOH溶液反应:OH﹣+HCO ![]() =CO
=CO ![]() +H2O
+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬是用途广泛的金属元素,但在生产过程中易产生有害的含铬工业废水.
(1)还原沉淀法是处理含Cr2O72﹣和CrO42﹣工业废水的一种常用方法,其工艺流程为:CrO42﹣ ![]() Cr2O72﹣
Cr2O72﹣ ![]() Cr3+
Cr3+ ![]() Cr(OH)3↓
Cr(OH)3↓
其中第Ⅰ步存在平衡:
2CrO42﹣(黄色)+2H+Cr2O72﹣(橙色)+H2O
①若平衡体系的pH=0,该溶液显色.
②根据2CrO42﹣+2H+Cr2O72﹣+H2O,设计如右图装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7 . Na2Cr2O7中铬元素的化合价为 , 图中右侧电极连接电源的极,其电极反应式为 .
③第Ⅱ步反应的离子方程式: .
(2)CrO3具有强氧化性,遇到有机物(如酒精)时,猛烈反应以至着火.若该过程中乙醇被氧化成乙酸,CrO3被还原成绿色的Cr2(SO4)3 . 完成该反应的化学方程式:
□CrO3+□C2H5OH+□H2SO4═□Cr2(SO4)3+□CH3COOH+□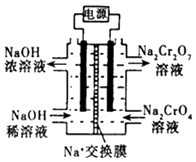
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四块金属片,用导线两两相连插入稀硫酸中,可以组成各种原电池。若A和B相连时,A为负极;C与D相连时,C溶解,D上有氢气生成;A与C相连时,C为正极;B与D相连时,电子由D极经导线流向B极,则这四种金属的活泼性由强到弱的顺序为( )
A. ABCDB. ACDBC. CADBD. BDCA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com