
【题目】下表为元素周期表的短周期部分
a | |||||||
b | c | d | |||||
e | f | g | h |
请参照元素a﹣h在表中的位置,根据判断出的元素回答问题:
(1)h原子核外有______ 种不同伸展方向的电子云,最外层共有______ 种不同运动状态的电子。
(2)比较d、e元素常见离子的半径大小(用化学式表示)______>______;b、c 两元素非金属性较强的是(写元素符号)______,写出证明这一结论的一个化学方程式______。
(3)d、e元素形成的四原子化合物的电子式为______;b、g元素形成的分子bg2为______分子(填写“极性”或“非极性”)。
(4)上述元素可组成盐R:ca4f(gd4)2,和盐S:ca4agd4,相同条件下,0.1mol/L 盐R中c(ca4+)______(填“等于”、“大于”或“小于”)0.1mol/L 盐S中c(ca4+)
(5)向盛有10mL1mol/L盐S溶液的烧杯中滴加1mol/L NaOH溶液至中性,则反应后各离子浓度由大到小的排列顺序是______。
(6)向盛有10mL 1mol/L盐 R溶液的烧杯中滴加1mol/L NaOH溶液32mL后,继续滴加至35mL写出此时段(32mL﹣35mL)间发生的离子方程式:______。若在10mL 1mol/L 盐R溶液的烧杯中加20mL1.2mol/L Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为______mol。
【答案】4 7 O2﹣ Na+ N 2HNO3+Na2CO3 =2NaNO3+CO2↑+H2O ![]() 非极性 小于 c(Na+)>c(SO42﹣)>c(NH4+)>c(OH﹣)=c(H+) NH4++OH﹣=NH3H2O 0.022
非极性 小于 c(Na+)>c(SO42﹣)>c(NH4+)>c(OH﹣)=c(H+) NH4++OH﹣=NH3H2O 0.022
【解析】
由元素在周期表中位置可知,a为H、b为C、c为N、d为O、e为Na、f为Al、g为S、h为Cl。
(1)h为Cl,原子核外电子排布为1s22s22p63s23p5,只有s、p轨道电子云,有4种伸展方向不同的电子,核外没有运动状态相同的电子,最外层有7种运动状态不同的电子;故答案为:4;7。
(2)电子层结构相同的离子,核电荷数越大离子半径越小,故离子半径:O2>Na+,同周期自左而右元素非金属性增强,故非金属性N>C,可以利用最高价含氧酸中强酸制备弱酸进行验证,反应方程式为:2HNO3+Na2CO3=2NaNO3+CO2↑+H2O;故答案为:O2;Na+;N;2HNO3 + Na2CO3=2NaNO3+CO2↑+H2O。
(3)d、e元素形成的四原子化合物为Na2O2,电子式为:![]() ,b、g元素形成的分子CS2为直线型对称结构,分子中正负电荷重心重合,属于非极性分子;故答案为:
,b、g元素形成的分子CS2为直线型对称结构,分子中正负电荷重心重合,属于非极性分子;故答案为:![]() ;非极性。
;非极性。
(4)NH4Al(SO4)2溶液中铵根离子与铝离子相互抑制水解,而NH4HSO4溶液中氢离子抑制铵根离子水解,铝离子抑制程度不如酸的抑制程度大,则NH4HSO4溶液中铵根离子浓度更大;故答案为:小于。
(5)NH4HSO4与NaOH按物质的量1:1反应时生成物为硫酸钠、硫酸铵混合溶液,溶液呈酸性,二者混合呈中性,还有一水合氨生成,为硫酸钠、硫酸铵、一水合氨混合溶液,则反应后各离子浓度由大到小的排列顺序是:c(Na+)>c(SO42﹣)>c(NH4+)>c(OH﹣)=c(H+)。
(6)10mL 1molL1 NH4Al(SO4)2溶液中Al3+物质的量为0.01mol,NH4+物质的量为0.01mol,SO42物质的量为0.02mol,32mL 1 molL1 NaOH溶液中NaOH物质的量为0.032L×1 molL1=0.032mol,由Al3++3OH- = Al(OH)3↓,可知完全沉淀铝离子消耗0.03mol NaOH,消耗NaOH溶液30mL,由NH4+ + OH- = NH3·H2O,可知铵根离子完全反应消耗NaOH为0.01mol,又消耗NaOH溶液10mL,故加入32mLNOH溶液后,继续滴加至35mL时反应离子方程式为:NH4+ + OH- = NH3·H2O;20mL 1.2 molL1 Ba(OH)2溶液中Ba2+物质的量为0.024mol,OH为0.048molspan>,由SO42 + Ba2+ = BaSO4↓,可知SO42不足,故可以得到0.02mol BaSO4,根据Al3++3OH-= Al(OH)3↓,0.01mol Al3+ 消耗0.03mol OH-生成0.01mol Al(OH)3沉淀,此时剩余n(OH-) = 0.048mol- 0.03mol = 0.018mol,再发生反应NH4++OH- = NH3·H2O,0.01mol NH4+消耗0.01mol OH-,生成0.01 mol NH3·H2O,此时反应剩余n(OH-)=0.018mol-0.01mol=0.008mol,继而发生Al(OH)3+OH-=AlO2-+ 2H2O,0.008mol OH-溶解0.008mol Al(OH)3,此时剩余Al(OH)3沉淀为0.01mol-0.008mol = 0.002mol,则最终得到固体为0.02mol+0.002mol=0.022mol;故答案为:NH4+ + OH- = NH3·H2O;0.022。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列热化学方程式及其有关叙述正确的是( )
A.氢气的燃烧热为285.8kJ·mol-1,则水分解的热化学方程式为2H2O(l)=2H2(g)+O2(g) ΔH =+571.6kJ·mol-1
B.已知2C(石墨,s)+O2(g)=2CO(g) ΔH =+221kJ·mol-1,则石墨的燃烧热110.5kJ·mol-1
C.已知N2(g)+3H2(g) ![]() 2NH3(g) ΔH=-92.4kJ·mol-1,则在一定条件下将1mol N2和3mol H2置于一密闭容器中充分反应,放出92.4kJ的热量
2NH3(g) ΔH=-92.4kJ·mol-1,则在一定条件下将1mol N2和3mol H2置于一密闭容器中充分反应,放出92.4kJ的热量
D.已知乙炔的燃烧热为![]() ,则表示乙炔燃烧热的热化学方程式为
,则表示乙炔燃烧热的热化学方程式为![]() ΔH=
ΔH=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铁矿主要成分是 FeS2。某硫酸厂在进行黄铁矿成分测定时,取 0.1000 g 样品在空气中充分灼烧,将生成的SO2气体与足量Fe2(SO4)3溶液完全反应后,用浓度为 0.02000 mol·L-1的 K2Cr2O7标准溶液滴定至终点,重复实验,平均消耗K2Cr2O7标准溶液 20.00mL。
(1)硫酸工业中煅烧黄铁矿的设备名称_____。
(2)该样品FeS2的质量分数为_____;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素![]() 、
、![]() 、
、![]() 在周期表中的相对位置如图所示。已知
在周期表中的相对位置如图所示。已知![]() 元素原子的外围电子排布式为
元素原子的外围电子排布式为![]() ,则下列说法不正确的是( )
,则下列说法不正确的是( )

A.![]() 元素原子的价电子排布式为
元素原子的价电子排布式为![]()
B.![]() 元素在元素周期表的第三周期第ⅥA族
元素在元素周期表的第三周期第ⅥA族
C.![]() 元素所在周期中所含非金属元素最多
元素所在周期中所含非金属元素最多
D.![]() 元素原子的核外电子排布式为
元素原子的核外电子排布式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D是四种短周期元素,E是过渡金属元素。A、B、C同周期,C、D同主族,A的原子结构示意图为 ,B的核外电子排布式为
,B的核外电子排布式为![]() ,C的最外层有三个单电子,E的价电子排布式为
,C的最外层有三个单电子,E的价电子排布式为![]() 。试回答下列问题:
。试回答下列问题:
(1)写出下列元素的符号:A______,B______,C______,D______。
(2)E元素原子的核电荷数是______,E元素在周期表中位于第______周期第______族;已知元素周期表可按电子排布分为![]() 区、
区、![]() 区、
区、![]() 区等,则E元素在______区。
区等,则E元素在______区。
(3)画出D的核外电子排布图:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某高分子有机物P的合成路线如下:
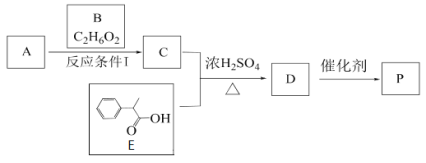
已知1 mol B与足量的金属钠反应产生标况下22.4L氢气
(1)A是2-甲基丙烯酸,A的结构简式是______________,E的化学式为___________________
(2)A和B生成C的反应类型是________,D生成P的反应类型是______________
(3)A与过量的B反应生成C,若A过量,则得到C′, C′的结构简式为__________________
(4)P用NaOH溶液处理,完全水解的化学方程式是:_________________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.某有机物燃烧只生成CO2和H2O,且二者物质的量相等,则此有机物的组成为CnH2n
B.一种烃在足量的氧气中燃烧并通过浓硫酸,减少的总体积就是生成的水蒸气的体积
C.某气态烃CxHy与足量O2恰好完全反应,如果反应前后气体体积不变(温度>100℃),则y=4;若体积减小,则y>4;否则y<4
D.相同质量的烃,完全燃烧,消耗O2越多,烃中含H量越高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示电化学装置,X可能为“锌棒”或“碳棒”,下列叙述错误的是

A.X为锌棒,仅闭合K1,Fe电极上发生还原反应
B.X为锌棒,仅闭合K1,产生微量电流方向:Fe→X
C.X为碳棒,仅闭合K2,该电化学保护法称为“牺牲阳极阴极保护法”
D.若X为碳棒,仅闭合K1,铁电极的极反应为:Fe -2e- → Fe2+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com