
| A、乙烯的结构简式:CH2CH2 |
| B、醛基的结构简式:-COH |
C、丙烷分子的比例模型为: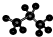 |
D、甲烷的电子式: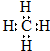 |
 为丙烷的球棍模型,丙烷的比例模型为:
为丙烷的球棍模型,丙烷的比例模型为: ,故C错误;
,故C错误;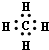 ,故D正确.
,故D正确.

科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 四种物质 | 甲 | 乙 | 丙 | 丁 |
| 反应前质量(g) | 25 | 15 | 1 | 5 |
| 反应后质量(g) | 11 | 未测 | 1 | 22 |
| A、该反应是复分解反应 |
| B、丙一定是催化剂 |
| C、乙全部发生了反应 |
| D、甲与乙反应的质量比为14:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下,23g NO2含有NA个氧原子 | ||
| B、0.1mol?L-1的烧碱溶液中含有0.1NA个Na + | ||
| C、22.4 L的CO气体与1 mol N2所含的分子数相等 | ||
D、9 g
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、浓NaOH溶液与浓CaCl2溶液混合:Ca2++2OH-=Ca(OH)2↓ |
| B、氯化铝溶液中滴加氨水生成沉淀:Al3++3OH-=Al(OH)3↓ |
| C、利用醋酸溶解含碳酸钙的水垢CaCO3+2H+=Ca2++H2O+CO2↑ |
| D、NaHSO4溶液中滴加NaHCO3溶液:2H++CO32-=CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
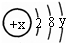 试回答:
试回答:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
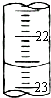 为了测定某NaOH样品中NaOH的质量分数(杂质不参与反应),某化学兴趣小组进行了如下实验:
为了测定某NaOH样品中NaOH的质量分数(杂质不参与反应),某化学兴趣小组进行了如下实验:| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.00 | 21.01 |
| 2 | 25.00 | 2.00 | 24.00 |
| 3 | 25.00 | 0.20 | 20.19 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com