
【题目】Fe(OH)3可用来制颜料、药物,作净水剂。现设计实验研究制备Fe(OH)3的方法。
资料:新制Fe(OH)3在溶液中存在两种电离:Fe3++3OH-![]() Fe(OH)3
Fe(OH)3![]() H++FeO2-+H2O
H++FeO2-+H2O
(1)向3支盛有1 mL 1.0 mol·L-1 FeCl3溶液的试管中,分别加入3 mL不同浓度的NaOH溶液,都产生红褐色沉淀。充分反应后,过滤,取滤液分成两等份,分别进行实验,实验记录如下:
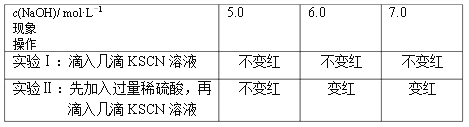
① 产生红褐色沉淀的离子方程式是________。
② 当c(NaOH)≥6.0 mol·L-1时,实验Ⅱ中溶液变红的原因是________、________(用离子方程式表示)。
(2)有同学提出可用某些盐与FeCl3反应制备Fe(OH)3。
① 向1 mL 1.0 mol·L-1 FeCl3溶液中滴加1.0 mol·L-1 Na2CO3溶液,立即有大量气泡并有红褐色沉淀产生。有同学提出沉淀中可能含有碳酸盐。将沉淀过滤、洗涤后取样,________,证明沉淀中含有碳酸盐。
② 向1 mL 1.0 mol·L-1 FeCl3溶液中滴加1.0 mol·L-1 Na2SO3溶液,溶液由黄色变为红色,无丁达尔效应,继续滴加Na2SO3溶液,最终得到红褐色沉淀。经检验沉淀中除Fe(OH)3外还含有FeSO3。产生FeSO3的原因是_________________。
(3)比较(1)和(2),制备Fe(OH)3的合理方法是___________(注明试剂和用量)。
(4)FeSO4溶液仅与一种试剂反应也可制Fe(OH)3,该试剂的化学式是________(写出一种即可)。
【答案】
(1)①Fe3++3OH-=Fe(OH)3↓;
②FeO2-+4H+=Fe3++2H2O;Fe3++3SCN-=Fe(SCN)3;
(2)①加入少量稀盐酸,有无色气体产生;
②2Fe3++SO32-+H2O=2Fe2++SO42-+2H+、Fe2++SO32-=FeSO3↓;
(3)1mL1.0mol·L-1FeCl3溶液与3mL浓度小于6.0mol·L-1的NaOH溶液;
(4)Na2O2、NaClO等;
【解析】
试题分析:(1)① 氯化铁与氢氧化钠反应生成红褐色沉淀,反应的离子方程式为Fe3+ + 3OH-=Fe(OH)3↓,故答案为:Fe3+ + 3OH-=Fe(OH)3↓;②新制Fe(OH)3在溶液中存在两种电离:Fe3++3OH-![]() Fe(OH)3
Fe(OH)3![]() H++FeO2-+H2O,当c(NaOH)≥6.0 mol·L-1时,FeO2- + 4H+=Fe3+ + 2H2O;Fe3++ 3SCN-=Fe(SCN)3溶液变红,故答案为:FeO2- + 4H+=Fe3+ + 2H2O;Fe3++ 3SCN-=Fe(SCN)3;
H++FeO2-+H2O,当c(NaOH)≥6.0 mol·L-1时,FeO2- + 4H+=Fe3+ + 2H2O;Fe3++ 3SCN-=Fe(SCN)3溶液变红,故答案为:FeO2- + 4H+=Fe3+ + 2H2O;Fe3++ 3SCN-=Fe(SCN)3;
(2)有同学提出可用某些盐与FeCl3反应制备Fe(OH)3。
① 向1 mL 1.0 mol·L-1 FeCl3溶液中滴加1.0 mol·L-1 Na2CO3溶液,立即有大量气泡并有红褐色沉淀产生。要证明沉淀中可能含有碳酸盐。只需要将沉淀过滤、洗涤后取样,加入少量稀盐酸,看是否有无色气体产生即可,故答案为:加入少量稀盐酸,有无色气体产生;
② 三价铁离子具有氧化性,与亚硫酸钠发生氧化还原反应,2Fe3+ + SO32-+H2O=2Fe2+ + SO42-+2H+,进而生成FeSO3,Fe2+ + SO32-=FeSO3↓,故答案为:2Fe3+ + SO32-+H2O=2Fe2+ + SO42-+2H+、Fe2+ + SO32-=FeSO3↓;
(3)比较(1)和(2)数据,pH大于等于6时,溶液中仍然含有铁离子,因此制备Fe(OH)3的合理方法是1 mL 1.0 mol·L-1 FeCl3溶液与3 mL浓度小于6.0 mol·L-1的NaOH溶液,故答案为:1 mL 1.0 mol·L-1 FeCl3溶液与3 mL浓度小于6.0 mol·L-1的NaOH溶液;
(4)FeSO4溶液仅与一种试剂反应也可制Fe(OH)3,该试剂具有氧化性,能够将亚铁离子氧化为铁离子,同时生成的溶液具有碱性,该试剂可以是Na2O2、NaClO等,故答案为:Na2O2、NaClO等。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】如图所示,通电5 min时:第③极增重2.16 g,并且观察到A池中只有一个电极在产生气体,通电5min后 ,A池两极均有气体产生。设A池中原混合液的体积为200 mL,求
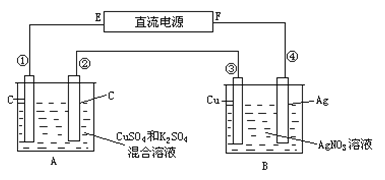
(1)直流电源E是________极;
(2)通电前A池中原混合溶液Cu2+的浓度____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废铅蓄电池量急速增加所引起的铅污染日益严重。工业上从废铅蓄电池的铅膏中回收铅的工艺流程如下:
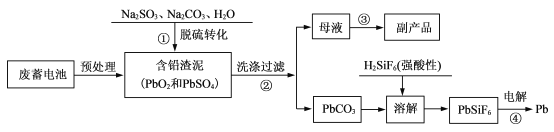
(1)铅蓄电池的总反应为Pb+ PbO2+2H2SO4 =2PbSO4+2H2O,该蓄电池放电时的负极反应式为__________,放电后该电极质量_______(填“增大”“减小”或“不变”)。
(2)步骤①中加入Na2SO3的作用是____________。
(3)写出步骤②证明PbCO3沉淀已经洗涤干净的实验操作方法:_______________。
(4)若用NH4HCO3和NH3·H2O为脱硫转化剂,也可对上述流程中的含铅渣泥进行处理。如图是NH4 HCO3和NH3.H2O用量对含铅渣泥中脱硫率的影响:
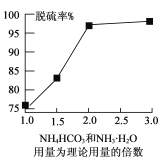
从图形可以看出,应选择NH4HCO3和NH3·H2O用量为理论用量的__________倍。该条件下步骤③从母液可获得副产品为_______________ 。
(5)步骤④使用纯铅和粗铅作电极,PbSiF6作电解质,可进行粗铅精炼。则阳极的电极材料是_________,阴极的电极反应式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中既含有离子键又含有共价键的是( )
A. NaOH、H2O、NH4Cl B. KOH、Na2O2、(NH4)2S
C. H2O2 、MgO、Na2SO4 D. CaBr2 、HCl、 MgCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把单质铁加入氯化铜、氯化亚铁、氯化铁和盐酸混合溶液中,反应后铁有剩余,则溶液中浓度最大的阳离子是( )
A. Cu2+ B. Fe2+ C. Fe3+ D. H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用漂白粉溶液浸泡过的有色布条,如果晾置在空气中,过了一段时间,其漂白效果会更好的原因可能是
A. 漂白粉被氧化了
B. 有色布条被空气中的氧气氧化了
C. 漂白粉溶液跟空气中的CO2的反应充分,生成了较多量的次氯酸
D. 漂白粉溶液蒸发掉部分水,其浓度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属腐蚀的电化学原理可用下图模拟。

(1)请写出有关电极反应式:_________________________
①铁棒上的电极反应式:_______________________
碳棒上的电极反应式:_________________________
(2)该图所表示的是_________________________(填“析氢”或“吸氧”)腐蚀。
(3)若将O2撤走,并将NaCl溶液改为稀H2SO4溶液,则此图可表示__________(填“析氢”或“吸氧”)腐蚀原理;若用牺牲阳极法来保护铁棒不被腐蚀溶解,即可将碳棒改为_________棒。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示.下列说法正确的是( )

A. 元素X与元素Z的最高正化合价之和的数值等于8
B. 原子半径的大小顺序为:rX>rY>rZ>rW>rQ
C. 离子Y2﹣和Z3+的核外电子数和电子层数都不相同
D. 元素W的最高价氧化物对应的水化物的酸性比Q的强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com