
【题目】从海水中可以获得淡水、食盐并可提取镁和溴等物质.
(1)海水淡化的方法主要有(填一种);
(2)下列物质不需要经过化学变化就能从海水中获得的物质是 (填序号);
A.液溴
B.食盐
C.氢气
D.淡水
(3)从海水中提取溴和镁的流程如下: 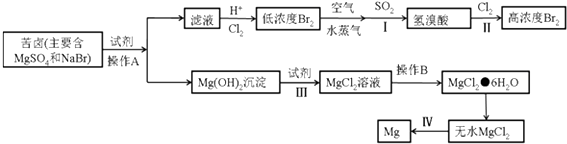
①写出下列步骤的离子方程式或化学方程式
步骤I的化学方程式: ,
步骤III的离子方程式: ,
步骤IV的化学方程式: .
②操作A是 , 操作B是 , 从步骤II得到的溶液中提取溴还需要进行的操作有:、萃取、蒸馏.
【答案】
(1)蒸馏法
(2)BD
(3)SO2+Br2+H2O══2HBr+H2SO4 ;Mg(OH)2+2H+=Mg2++2H2O;MgCl2(熔融) ![]() ?Mg+Cl2↑;过滤;冷却结晶;分液
?Mg+Cl2↑;过滤;冷却结晶;分液
【解析】解:(1)海水淡化的常用方法为:海水冻结法、电渗析法、蒸馏法、离子交换法,故答案为:海水冻结法、电渗析法、蒸馏法、离子交换法(选填其中一个);
(2.)A.通过电解熔融氯化钠得到钠和氯气,是化学变化,通过氯气将溴离子氧化为溴单质,是化学变化,故A错误;B.把海水用太阳暴晒,蒸发水分后即得食盐,不需要化学变化就能够从海水中获得,故B正确;通过电解熔融氯化钠得到钠和氯气,是化学变化,通过电解熔融的氯化镁和氧化铝即得镁和铝,是化学变化,故B正确;C.海水中氢元素为化合态,电解水生成氢气,或电解饱和食盐水生成氢气发生了化学反应,是化学变化,故C错误;D.把海水用蒸馏等方法可以得到淡水,无化学变化,故D正确;故答案为:BD;
(3.)①步骤I是二氧化硫和溴单质发生氧化还原反应生成硫酸和溴化氢,反应的化学方程式为:SO2+Br2+H2O══2HBr+H2SO4 , 故答案为:SO2+Br2+H2O══2HBr+H2SO4 ;
步骤III是氢氧化镁溶解于盐酸生成氯化镁溶液,反应的离子方程式为:Mg(OH)2+2H+=Mg2++2H2O,故答案为:Mg(OH)2+2H+=Mg2++2H2O;
步骤IV是电解熔融氯化镁得到金属镁和氯气,反应的化学方程式为:MgCl2(熔融) ![]() Mg+Cl2↑,故答案为:MgCl2(熔融)
Mg+Cl2↑,故答案为:MgCl2(熔融) ![]() Mg+Cl2↑;
Mg+Cl2↑;
②操作A是分离固体和溶液的操作为过滤,操作B是溶液中分离得到溶质固体的操作,通常是蒸发浓缩、冷却结晶、过滤洗涤得到氯化镁晶体,从步骤II得到的溶液中提取溴还需要进行的操作是萃取分液后蒸馏得到液溴,
故答案为:过滤,冷却结晶,分液;
(1.)根据海水淡化的常用方法:海水冻结法、电渗析法、蒸馏法、离子交换法;
(2.)从海水提物质的原理去分析,
A.海水中溴元素为离子,变化为单质需要发生化学反应;
B.海水用太阳暴晒,蒸发水分后即得食盐;
C.氢元素海水中存在是化合态,变化为氢气需要发生化学反应;
D.海水淡化是分离出纯净水,变化过程中无新物质生成,是物理变化;
(3.)苦卤中主要是硫酸镁和溴化镁,加入试剂氢氧化钙沉淀镁离子过滤得到氢氧化镁沉淀,加入试剂Ⅲ为盐酸,氢氧化镁溶解于盐酸得到氯化镁溶液,通过操作B蒸发浓缩,冷却结晶、过滤洗涤得到氯化镁晶体,在氯化氢气流中加热失去结晶水得到固体氯化镁,步骤Ⅳ是电解固体氯化镁得到金属镁和氯气,沉淀镁离子后的滤液中酸化通入氯气氧化溴离子生成溴单质,得到低浓度的溴单质溶液,用空气吹出溴单质,用二氧化硫吸收辐射氧化还原反应生成溴化氢,再通入氯气氧化溴化氢得到高浓度的溴单质,①步骤I是二氧化硫和溴单质发生氧化还原反应生成硫酸和溴化氢;步骤III是氢氧化镁溶解于盐酸生成氯化镁溶液步骤IV是电解熔融氯化镁得到金属镁和氯气;②分析可知操作A是分离固体和溶液的操作为过滤,操作B是溶液中分离得到溶质固体的操作,通常是蒸发浓缩、冷却结晶、过滤洗涤得到氯化镁晶体,从步骤II得到的溶液中提取溴还需要进行的操作是萃取分液后蒸馏得到液溴;


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】关于NaHCO3的性质,下列说法正确的是(双选)( )
A.和酸反应放出等量的CO2所消耗的酸比Na2CO3少
B.相同温度下溶解度比Na2CO3要大
C.热稳定性比Na2CO3大
D.NaHCO3只能和酸作用不能和碱作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃料电池是一种能量转换效率高、对环境友好的化学电源,图为一种氢氧燃料电池的结构装置. 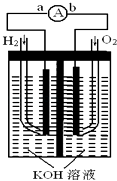
(1)电极b为该燃料电池的极(填“正”或“负”),电极方程式为;
(2)电池工作时,溶液中的OH﹣移向极(填“a”或“b”);
(3)电池工作时,在导线中电子流动方向为(用a、b表示);
(4)电池使用一段时间后,溶液的pH值(填“增大”或“减小”);
(5)当电池工作一段时间后消耗标准状况下H2为6.72L时,转移电子mol.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锡及其化合物在生产、生活中有着重要的用途。已知: Sn的熔点为231℃;Sn2+易水解、易被氧化;SnCl4极易水解、熔点为-33℃、沸点为114℃。请回答下列问题:
(1)元素锡比同主族碳的周期数大3,锡的原子序数为_________。
(2)用于微电子器件生产的锡粉纯度测定(已知锡的相对原子质量为119): ①取1.19g试样溶于稀硫酸中(杂质不参与反应),使Sn 完全转化为Sn2+;②加入过量的Fe2(SO4)3;③用0.1000mol/LK2Cr2O7溶液滴定(产物中Cr呈+3价),消耗20.00mL。步骤②中加入Fe2(SO4)3的作用是________;此锡粉样品中锡的质量分数为_________。若在滴定终点时俯视读数,则会导致测得的样品中锡的质量分数________(填“偏高“偏低”或“无影响”)。
(2)用于镀锡工业的硫酸亚锡(SnSO4)的制备路线如下:

①步骤I加入Sn粉的作用:____________及调节溶液pH。
②步骤II用到的玻璃仪器有烧杯、____________。
③步骤III生成SnO的离子方程式: ____________。
④步骤IV中检验SnO是否洗涤干净的操作是____________,证明已洗净。
⑤步骤V操作依次为____________ 、____________过滤、洗涤、低温干燥。
(4)实验室欲用下图装置制备少量SnCl4(夹持装置略),该装置存在明显缺陷,改进方法是____________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中一定量混合气体发生反应:xA(g)+yB(g) ![]() zC(g)平衡时测得A的浓度为0.5 mol·L-1,保持温度不变,将容器的容积扩大到原来的2倍,再达平衡时测得A的浓度为0.2 mol·L-1,下列判断正确的是( )
zC(g)平衡时测得A的浓度为0.5 mol·L-1,保持温度不变,将容器的容积扩大到原来的2倍,再达平衡时测得A的浓度为0.2 mol·L-1,下列判断正确的是( )
A. 平衡向正反应方向移动 B. x+y>z
C. C的体积分数保持不变 D. B的转化率降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】胶体区别于其它分散系的本质特征是
A. 胶体粒子带电荷 B. 胶体粒子的直径在1~100nm之间
C. 胶体粒子能够发生布朗运动 D. 胶体粒子不能穿过半透膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物莫沙朵林(F)是一-种镇痛药,它的合成路线如下:

(1)A![]() B的转化属于______________反应(填反应类型),1mol B与足量的金属钠反应可以生成标况下的氢气_________L,B的沸点远高于相对分子质量接近的烃类,其原因是_______。
B的转化属于______________反应(填反应类型),1mol B与足量的金属钠反应可以生成标况下的氢气_________L,B的沸点远高于相对分子质量接近的烃类,其原因是_______。
(2)化合物D中含氧官能团的名称为__________
(3)化合物C与新制氢氧化铜悬浊液反应的化学方程式为____________
(4)下列有关化合物E的说法中正确的是__________(填序号)。
A.化合物E的分子式为C9H12O3
B.化合物E能使酸性KMnO4溶液和溴水褪色
C.1mol E发生加成反应最多消耗2 mol H2
D.E中既有非极性共价键也有极性共价键
(5)写出同时满足下列条件的E的一种同分异构体的结构简式:__________;
I.分子的核磁共振氢谱图中有4组峰;
Ⅱ.能发生银镜反应和水解反应;
Ⅲ.能与FeCl3溶液发生显色反应,且与溴水反应。
1mol该同分异构体与足量NaOH溶液反应,最多可消耗________molNaOH。
(6)已知E+X![]() F为加成反应,则化合物X的结构简式为__________。
F为加成反应,则化合物X的结构简式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的碳酸钠和氢氧化钠的固体混合物完全溶于水,制成180mL稀溶液,然后向该溶液中逐滴加入1 mol·L-1的盐酸,所加入盐酸的体积与产生CO2的体积(标准状况)关系如下图所示:(提示:假设V混=V1+V2)
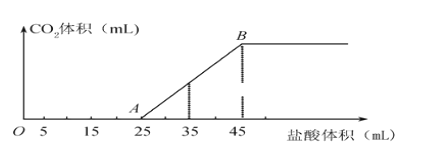
(1)写出OA段所发生反应的化学方程式_____________________,________________________。
(2)当加入35 mL盐酸时,产生CO2的体积为_______________________mL(标准状况)。
(3)原混合物中NaOH的质量为________g。
(4)B点时溶液中钠离子的物质的量浓度为_______________mol·L-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com