
【题目】利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥中Cr(Ⅲ)的处理工艺流程如下:

已知:①硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
②Cr2O72-+H2O2CrO42-+2H+
③常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
阳离子 | Fe3+ | Mg2+ | Al3+ | Cr3+ |
沉淀完全时的pH | 3.7 | 11.1 | 5.4(>8溶解) | 9(>9)溶解 |
(1)实验室用18.4mol·L-1的浓硫酸配制480mL2mol·L-1的硫酸,配制时所用玻璃仪器除烧杯、玻璃棒和胶头滴管外,还需_______。
(2)H2O2的作用是将滤液Ⅰ中的Cr3+转化为Cr2O72-,写出此反应的离子方程式:_______。
(3)加入NaOH溶液使溶液呈碱性,既可以除去某些杂质离子,同时又可以将Cr2O72-转化为______(填微粒的化学式)。
(4)钠离子交换树脂的反应原理为Mn++nNaR=MRn+nNa+,则利用钠离子交换树脂可除去滤液Ⅱ中的金属阳离子有_____。
(5)写出上述流程中用SO2进行还原时发生反应的离子方程式:_____。
(6)沉淀滴定法是测定粒子浓度的方法之一,为了测定某废水中SCN-的浓度,可用0.1000mol·L-1AgNO3标准溶液滴定待测液,已知:

①滴定时可选为滴定指示剂的是_______(填编号),滴定终点的现象是_______。
A.NaCl B.K2CrO4 C.KI D.NaCN
②取某废水25.00ml,滴定终点时消耗AgNO3标准溶液10.00ml,则废水中SCN-的物质的量浓度为_______。
【答案】500mL容量瓶、量筒 2Cr3++3H2O2+H2O=Cr2O72-+8H+ CrO42- Mg2+、Ca2+ 2CrO42-+3SO2+12H2O=2Cr(OH)(H2O)5SO4↓+SO42-+2OH- B 当滴入最后一滴标准液时,出现砖红色沉淀,且半分钟内沉淀颜色不改变 0.04mol·L1
【解析】
向含铬污泥中加入稀硫酸和水并调节pH=1,浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+,过滤后的滤液中加入双氧水,Cr3+被氧化生成Cr2O72-,再向溶液中加入NaOH溶液并调节pH为8,根据表中数据可知,溶液中Fe3+、Al3+生成沉淀且溶液中Cr2O72-转化为CrO42-,然后过滤,向滤液中加入钠离子交换树脂,除去Ca2+和Mg2+,最后向溶液中通入SO2,发生反应:2CrO42-+3SO2+12H2O=2Cr(OH)(H2O)5SO4↓+SO42-+2OH-,根据以上进行解答。
(1)配制480mL所需溶液,应选用500mL的容量瓶,根据溶液稀释前后溶质的物质的量不变列式:18.4molL-1V(浓硫酸)=2molL-150010-3mL,解得V=54.3mL,配制时所需玻璃仪器除烧杯、玻璃棒和胶头滴管外,还需500mL的容量瓶、量筒。
答案为:500mL的容量瓶、量筒。
(2)H2O2将Cr3+氧化成Cr2O72-,H2O2被还原,结合原子守恒、电荷守恒、得失电子守恒以及溶液呈酸性,H2O2将滤液Ⅰ中的Cr3+转化为Cr2O72-的离子方程式为:2Cr3++3H2O2+H2O=Cr2O72-+8H+。
答案为:2Cr3++3H2O2+H2O=Cr2O72-+8H+。
(3)根据各金属阳离子完全沉淀的pH,加入NaOH溶液调节pH=8,将Fe3+、Al3+完全转化为Fe(OH)3、Al(OH)3沉淀除去,同时将Cr2O72-转化为CrO42-,反应为:Cr2O72-+2OH-=2CrO42-+H2O。
答案为:CrO42-。
(4)加入NaOH溶液调节pH=8除去了浸取液中Fe3+和Al3+,根据浸取液中含有的金属阳离子和钠离子交换树脂的反应原理,可知利用钠离子交换树脂除去滤液Ⅱ中的金属阳离子为Mg2+、Ca2+。
答案为:Mg2+、Ca2+。
(5)SO2将CrO42-还原为Cr(OH)(H2O)5SO4,SO2被氧化为SO42-,S元素化合价由+4升到+6,Cr元素化合价由+6降到+3,根据得失电子守恒、原子守恒、电荷守恒及溶液呈碱性,写出离子方程式为;2CrO42-+3SO2+12H2O=2Cr(OH)(H2O)5SO4↓+SO42-+2OH-。
答案为:2CrO42-+3SO2+12H2O=2Cr(OH)(H2O)5SO4↓+SO42-+2OH-。
(6)①若用AgNO3滴定SCN-的浓度,可选用的指示剂与Ag+反应产物的Ksp应比AgSCN略大,且变化现象明显,从所给数据看,AgCl、Ag2CrO4满足,但由于AgCl为白色沉淀,与AgSCN颜色相同,故应选K2CrO4为滴定指示剂,这样在滴定终点时,沉淀的颜色发生明显变化(白色→砖红色)以指示滴定刚好达到终点,根据以上分析,滴定终点的现象是:当滴入最后一滴标准液时,出现砖红色沉淀,且半分钟内沉淀颜色不改变。
答案为:B;当滴入最后一滴标准液时,出现砖红色沉淀,且半分钟内沉淀颜色不改变。
②由滴定发生反应:Ag++SCN-=AgSCN↓可知:n(SCN-)=n(Ag+)=n(AgNO3)=0.1000mol·L-110.0010-3L=110-3mol,则c(SCN-)=![]() =0.04mol·L1。
=0.04mol·L1。
答案为:0.04mol·L1。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】已知KClO3和浓盐酸在一定温度下反应会生成黄绿色的易爆物二氧化氯。其变化可表述为2KClO3+4HCl(浓)=2KCl+2ClO2↑+Cl2↑+2H2O
(1)请分析该反应中电子转移的情况(用双线桥表示)______。
(2)浓盐酸在反应中显示出来的性质是____(填序号)。
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(3)若标准状况下产生4.48LCl2,被氧化的盐酸的物质的量为___mol,转移电子的物质的量_____mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醛(HCHO)俗称蚁醛,在化工、医药、农药等方面有广泛的应用。
I·甲醛的制备
工业上利用甲醇脱氢法制备甲醛,己知:CH3OH(g)![]() HCHO(g)+H2(g) △H
HCHO(g)+H2(g) △H
(1)该反应的能量变化如图甲所示,△H=___kJmol-1。
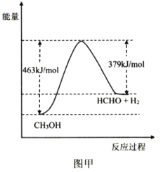
(2)为提高CH3OH转化率,采取的措施有___、___;在温恒容条件下,该反应达到平衡状态的标志有___(填标号)。
a.混合气体的密度保持不变
b.混合气体的总压强保持不变
c.v(CH3OH)消耗=v(H2)生成
d.甲醛的浓度保持不变
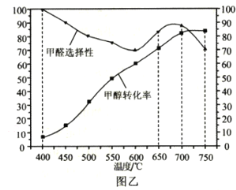
(3)选用Ag/SiO2—ZnO作催化剂,在400~750℃区间进行活性评价,图乙给出了甲醇转化率与甲醛选择性(选择性越大,表示生成该物质越多)随反应温度的变化曲线。制备甲醛的最佳反应温度为___(填标号),理由是___。
a.400℃ b.650℃ c.700℃ d.750℃
(4)T℃时,在2L恒容密闭容器中充入1mo1甲醇,发生反应:
①CH3OH(g)![]() HCHO(g)+H2(g)
HCHO(g)+H2(g)
②CH3OH(g)![]() CO(g)+2H2(g)
CO(g)+2H2(g)
平衡时甲醇为0.2mol,甲醛为0.7mo1。则反应i的平衡常数K=___。
II.甲醛的用途
(5)将甲醛水溶液与硫酸镍(NiSO4)溶液混合,可用于化学镀镍。反应过程中有CO2产生,则该反应的离子方程式为___:若收集到112mLCO2(标准状况),理论上转移电子___ mo1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学气敏传感器可用于监测环境中NH3的含量,其工作原理如图所示,其中NH3被氧化为常见的无毒物质。下列说法错误的是( )

A. 溶液中OH-向电极a移动
B. 电极b上发生还原反应
C. 负极的电极反应为2NH3-6e-+6OH-![]() N2+6H2O
N2+6H2O
D. 理论反应消耗的NH3与O2的物质的量之比为3:4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源是现代文明的原动力,通过化学方法可以使能量按人们所期望的形式转化,从而开辟新能源和提高能源的利用率,请回答下列问题。
(1)工业合成氨反应:N2+3H2 ![]() 2NH3是放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知1 mol N2完全反应生成NH3可放出92 kJ热量。如果将10 mol N2和足量H2混合,使其充分反应,放出的热量________(填“大于”、“小于”或“等于”)920kJ。
2NH3是放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知1 mol N2完全反应生成NH3可放出92 kJ热量。如果将10 mol N2和足量H2混合,使其充分反应,放出的热量________(填“大于”、“小于”或“等于”)920kJ。
(2)实验室模拟工业合成氨时,在容积为2 L的密闭容器内,反应经过10 min后,生成10 mol NH3
①则用N2表示的化学反应速率为__________________。
②一定条件下,当该反应进行到最大限度时,下列说法正确的是______(填编号)
a.N2的转化率达到最大值
b.N2、H2和NH3的体积分数之比为1 : 3 : 2
c.体系内气体的密度保持不变
d.体系内物质的平均相对分子质量保持不变
(3)某实验小组同学进行如下图所示实验,以检验化学反应中的能量变化。请根据你掌握的反应原理判断,②中的温度_______(填“升高”或“降低”)。反应过程____(填“①”或“②”)的能量变化可用图表示。

(4)用CH4和O2组合形成的质子交换膜燃料电池的结构如图:
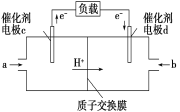
①则d电极是____(填“正极” 或“负极”),c电极的电极反应式为_____________________________。
②若线路中转移2 mol电子,则该燃料电池理论上消耗的O2在标准状况下的体积为______L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~F六种元素中,除C外其他均为短周期元素,它们的原子结构或性质如下表所示。
元素 | 原子结构或性质 |
A | 原子最外层电子数是内层电子总数的1/5 |
B | 形成化合物种类最多的元素,其单质为固体 |
C | 生活中常见的金属,它有两种常见的氯化物,且相对分子质量相差35.5 |
D | 地壳中含量最多的元素 |
E | 与D同主族 |
F | 与E同周期,且最外层电子数等于电子层数 |
请回答下列问题:(用对应的化学用语回答)
(1)B在元素周期表中的位置是__________;用电子式表示A和E形成的化合物的形成过程 。
(2)A、 D 、E、 F离子半径由大到小的顺序为________________________________。
(3)C的某种氯化物的浓溶液可以腐蚀印刷电路板上的金属铜,此反应的离子方程式是__________________;
(4)B的单质与D的氢化物在一定条件下反应生成BD和另一产物的化学方程式是____________________。该反应为 反应。(填“吸热”或“放热”)
(5)F的最高价氧化物与E的最高价氧化物的水化物反应的离子方程式为 。
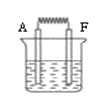
(6)如图:将A和F的单质与烧碱液构成原电池,负极的电极反应式为 ;外电路中电子从 电极流向 电极 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关Cl2的说法中,不正确的是![]()
A.Cl2是一种黄绿色的有毒气体
B.红热的铁丝在Cl2中燃烧生成FeCl2
C.工业上用Cl2和石灰乳制造漂白粉
D.新制氯水应避光保存
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国自主研发的对二甲苯绿色合成项目取得新进展,其合成过程如图所示。

下列说法不正确的是
A. 异戊二烯所有碳原子可能共平面
B. 可用溴水鉴别M和对二甲苯
C. 对二甲苯的一氯代物有2种
D. M的某种同分异构体含有苯环且能与钠反应放出氢气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com