
【题目】下列有关Cl2的说法中,不正确的是![]()
A.Cl2是一种黄绿色的有毒气体
B.红热的铁丝在Cl2中燃烧生成FeCl2
C.工业上用Cl2和石灰乳制造漂白粉
D.新制氯水应避光保存
科目:高中化学 来源: 题型:
【题目】实验测得0.1mo1·L-1Na2SO3溶液pH随温度升高而变化的曲线如图所示。将b点溶液冷却至25℃,加入盐酸酸化的BaC12溶液,能明显观察到白色沉淀。下列说法正确的是( )

A.Na2SO3溶液中存在水解平衡SO32-+2H2O![]() H2SO3+2OH-
H2SO3+2OH-
B.温度升高,溶液pH降低的主要原因是SO32-水解程度减小
C.a、b两点均有c(Na+)=2[c(SO32-)+c(HSO3-)+c(H2SO3)]
D.将b点溶液直接冷却至25℃后,其pH小于a点溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥中Cr(Ⅲ)的处理工艺流程如下:

已知:①硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
②Cr2O72-+H2O2CrO42-+2H+
③常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
阳离子 | Fe3+ | Mg2+ | Al3+ | Cr3+ |
沉淀完全时的pH | 3.7 | 11.1 | 5.4(>8溶解) | 9(>9)溶解 |
(1)实验室用18.4mol·L-1的浓硫酸配制480mL2mol·L-1的硫酸,配制时所用玻璃仪器除烧杯、玻璃棒和胶头滴管外,还需_______。
(2)H2O2的作用是将滤液Ⅰ中的Cr3+转化为Cr2O72-,写出此反应的离子方程式:_______。
(3)加入NaOH溶液使溶液呈碱性,既可以除去某些杂质离子,同时又可以将Cr2O72-转化为______(填微粒的化学式)。
(4)钠离子交换树脂的反应原理为Mn++nNaR=MRn+nNa+,则利用钠离子交换树脂可除去滤液Ⅱ中的金属阳离子有_____。
(5)写出上述流程中用SO2进行还原时发生反应的离子方程式:_____。
(6)沉淀滴定法是测定粒子浓度的方法之一,为了测定某废水中SCN-的浓度,可用0.1000mol·L-1AgNO3标准溶液滴定待测液,已知:

①滴定时可选为滴定指示剂的是_______(填编号),滴定终点的现象是_______。
A.NaCl B.K2CrO4 C.KI D.NaCN
②取某废水25.00ml,滴定终点时消耗AgNO3标准溶液10.00ml,则废水中SCN-的物质的量浓度为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取SO2的反应原理为:Na2SO3+H2SO4(浓)![]() Na2SO4+SO2↑+H2O。请用下列装置设计一个实验,以测定SO2转化为SO3的转化率:
Na2SO4+SO2↑+H2O。请用下列装置设计一个实验,以测定SO2转化为SO3的转化率:

(1)装置的连接顺序(按气体左右的方向)是____→_____→_____→_____→_______→_____→_____→_____(填各接口的编号)。
(2)从乙处均匀通入O2,为使SO2有较高的转化率,实验时Ⅰ处滴入浓硫酸与Ⅱ处加热催化剂的先后顺序是__________________________________________________。
(3)Ⅳ处观察到的现象是___________________________________________。
(4)若II中反应在适当的反应状况下,反应达最大限度以后,下列说法正确的是__________。
A.SO2浓度必定等于O2浓度的两倍
B.SO2、O2、SO3的分子数之比是2∶1∶2
C.SO2与O2不再化合生成SO3
D.反应混合物各成分的百分组成不再变化
(5)在Ⅰ处用大火加热烧瓶时,SO2的转化率会_______(填“增大”“不变”或“减小”)。
(6)用nmol Na2SO3粉末与足量浓硫酸进行此实验,当反应结束时,继续通入O2一段时间后,称得III处增重mg,则本实验中SO2的转化率为______________________。(用n、m表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是![]()
A.CO、NO、![]() 都是大气污染气体,在空气中都能稳定存在
都是大气污染气体,在空气中都能稳定存在
B.明矾在水中生成的![]() 胶体有吸附性,因此常用明矾对水进行消毒
胶体有吸附性,因此常用明矾对水进行消毒
C.![]() 、
、![]() 或
或![]() 都会导致酸雨的形成
都会导致酸雨的形成
D.活性炭、![]() 、
、![]() 都能使品红溶液褪色,原理不同
都能使品红溶液褪色,原理不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组进行有关Cu、硝酸、硫酸化学性质的实验,实验过程如图所示。下列有关说法正确的是
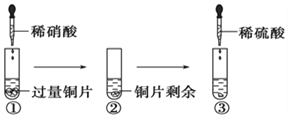
A.①中溶液呈蓝色,试管口有红棕色气体产生,稀硝酸被还原为NO2
B.③中反应的化学方程式:3Cu+Cu(NO3)2+4H2SO4=4CuSO4+2NO↑+4H2O
C.③中滴加稀硫酸,铜片继续溶解,说明稀硫酸的氧化性比稀硝酸强
D.由上述实验可知:Cu在常温下既可与稀硝酸反应,也可与稀硫酸反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下面的反应路线及所给信息填空。
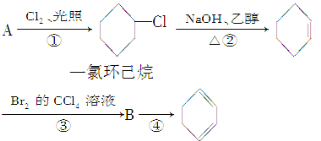
(1)A的结构简式是______,名称是______。
(2)①的反应类型是______,②的反应类型是______。
(3)反应④的化学方程式是__________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】非金属单质A经如图所示的过程转化为含氧酸D,已知D为强酸,请回答下列问题:
![]()
(1)若A在常温下为固体单质,B是能使品红溶液褪色的有刺激性气味的无色气体。
①写出B→C的化学方程式________________________________________。
②写出D+铜→B的化学方程式____________________________________。
(2)若A在常温下为气体单质,将装满气体C的试管倒扣在水槽中,溶液最终充满试管容积的![]() ,另外
,另外![]() 容积为无色气体。
容积为无色气体。
①A、C的化学式分别是:A____________;C___________。
②D的浓溶液在常温下可与铜反应并生成C气体,请写出该反应的离子方程式____。
(3)若A在常温下为非金属气态氢化物,B遇到空气变成红棕色。写出实验室制取A气体的化学方程式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ⅥA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种氧化态,含ⅥA族元素的化合物在研究和生产中有许多重要用途。请回答下列问题:
(1)已知H2O2的结构如图:

H2O2分子不是直线形的,两个H原子犹如在半展开的书的两面纸上,书页角为93°52′,而两个O—H键与O—O键的夹角均为96°52′。根据该结构写出H2O2分子的电子式______。估计它难溶于CS2,简要说明原因:________________。
(2)O、S、Se原子的第一电离能由大到小的顺序为____________________。
(3)H2Se的酸性比H2S_____(填“强”或“弱”)。气态SeO3分子的立体构型为______,SeO32-离子中Se的杂化方式为______。
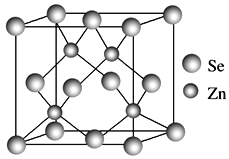
(4)硒化锌的晶胞结构如图所示,硒离子的配位数是____,若晶胞参数为d pm,则硒化锌的密度为______ g·cm-3。(不需要化简,1 m=109 nm=1012 pm)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com