
【题目】实验室可以用下图所示的装置制取乙酸乙酯。回答下列问题:

(1)制得的乙酸乙酯在饱和碳酸钠溶液的_______层。(填“上”或“下”)
(2)浓硫酸的作用是______________。
(3)制取乙酸乙酯的化学方程式是___________,该反应属于______(填反应类型)反应。
(4)生成乙酸乙酯的反应是可逆反应,反应一段时间后,就达到了该反应的限度。下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有(填序号)_________。
①混合物中各物质的浓度不再变化;
②单位时间里,生成1mol乙醇,同时生成1mol乙酸;
③单位时间里,生成1mol乙酸乙酯,同时生成1mol 乙醇。
【答案】 上 催化剂、吸水剂 CH3COOH + CH3CH2OH![]() CH3COOCH2CH3+ H2O 取代反应 ①③
CH3COOCH2CH3+ H2O 取代反应 ①③
【解析】(1)乙酸乙酯的密度小于水,不溶于饱和碳酸钠溶液,在液面的上层。
(2)浓硫酸的作用是催化剂、吸水剂。
(3)乙酸和乙醇在浓硫酸作用下发生取代反应生成乙酸乙酯。
(4)满足V(正)=V(逆),各组分的浓度保持不变,反应达到平衡状态,据此进行分析。
(1)乙酸乙酯不溶于饱和碳酸钠溶液,密度比水小,在碳酸钠溶液的上层;正确答案:上。
(2)再合成乙酸乙酯的反应中,浓硫酸起到了催化、吸水的作用,加快反应速率,有利于反应向右进行;正确答案:催化剂、吸水剂。
(3)制取乙酸乙酯的化学方程式是. CH3COOH + CH3CH2OH![]() CH3COOCH2CH3+ H2O;该反应属于取代反应;正确答案:CH3COOH + CH3CH2OH
CH3COOCH2CH3+ H2O;该反应属于取代反应;正确答案:CH3COOH + CH3CH2OH![]() CH3COOCH2CH3+ H2O ;取代反应。
CH3COOCH2CH3+ H2O ;取代反应。
(4)①混合物中各物质的浓度不再变化,各物质的量不再发生变化,反应已达到化学平衡状态,正确;②化学反应速率之比等于化学计量数之比,单位时间里,生成1mol乙醇(反应向左),同时生成1mol乙酸(反应向左),反应速率同向,不能说明乙醇与乙酸的酯化反应已达到化学平衡状态,错误;③单位时间里,生成1mol乙酸乙酯(反应向右),同时生成1mol乙醇(反应向左),满足正逆反应速率相等,说明乙醇与乙酸的酯化反应已达到化学平衡状态,正确;正确选项①③。


科目:高中化学 来源: 题型:
【题目】苯环上原有的取代基对新导入苯环上的取代基的位置有一定的影响,其规律如下: A.苯环上新导入的取代基所占的位置主要决定于原有取代基的性质
B.把原有取代基分成两类:第一类取代基主要使新导入的取代基进入苯环的邻位和对位,如﹣OH,﹣Br等;第二类取代基主要使新导入的取代基进入苯环的间位,如﹣NO2、﹣SO3H等.
已知A为硝基苯,按要求回答问题.
(1)请写出图中①③④三步反应的化学方程式. ①;③;④ . ①③④均为反应(填反应类型).
(2)请写出D、E的结构简式:DE .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置应用于实验室进行相关实验,能达到实验目的是( ) 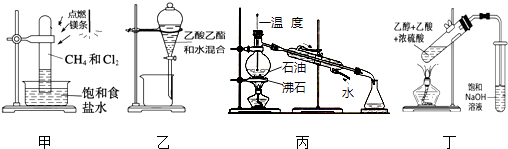
A.用装置甲在强光照条件下制取一氯甲烷
B.用装置乙分离乙酸乙酯和水
C.用装置丙蒸馏石油并收集60~150℃馏分
D.用装置丁制取并收集乙酸乙酯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钙[Ca(NO2)2]是水泥混凝土外加剂的主要原料,某学习小组设计实验制备亚硝酸钙,实验装置如图所示。(夹持装置略去)

已知:2NO+CaO2![]() Ca(NO2)2;2NO2+CaO2
Ca(NO2)2;2NO2+CaO2![]() Ca(NO3)2。
Ca(NO3)2。
Ca(OH)2+NO+NO2=Ca(NO2)2+H2O
请回答下列问题:
(1)向三颈烧瓶中加入稀硝酸之前,应向装置中通入一段时间的N2,原因是______________________。
(2)装置D的名称是__________;装置B中盛装的试剂是___________。
(3)装置F中的酸性K2Cr2O7溶液可将剩余的NO氧化成NO3-,溶液由橙色(Cr2O72-)变为绿色(Cr3+),发生反应的离子方程式为_______________________________。
(4)已知Ca(NO2)2溶液显弱碱性,其对应的酸容易分解,产生NO气体,设计实验证明装置F中有亚硝酸钙生成:_________________________________。
(5)工业上可用石灰乳和硝酸工业的尾气(含NO、NO2)反应,既能净化尾气,又能获得应用广泛的Ca(NO2)2。
①若n(NO)∶n(NO2)>1∶1,则会导致____________________________________;
②若n(NO)∶n(NO2)<1∶1,则会导致____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、X是中学化学常见的物质,A、B、C均由短周期元素组成,转化关系如图。
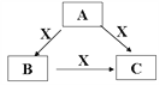
请针对以下三种不同情况回答:
(1)若A、B、C中均含同一种常见金属元素,该元素在C中以阴离子形式存在,向C的水溶液中通入过量的CO2可得B的白色胶状沉淀。
①A中含有的金属元素为_________(写元素名称),它在周期表中的位置为_____________。
②写出B → C反应的离子方程式为___________________________________。
(2)若A为稀HNO3,X为常见黑色金属单质,写出A→B反应的离子方程式__________。
(3)若A、B、C三种化合物的焰色反应均呈黄色,水溶液均为碱性;将C加到盐酸中,有无色无味的气体X产生。
①A中所含有的化学键是________________
②自然界中存在B、C和H2O按一定比例结晶而成的固体,取一定量该固体溶于水配成一定物质的量浓度的溶液100mL,所用到的玻璃仪器有玻璃棒、烧杯、________、_________。
③若测得上述溶液中金属阳离子的浓度为0.5mol/L。若取相同质量的固体加热至恒重,剩余固体的质量为 ____________ g 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列几项中,在生物体内含量较少,但是对于维持生物体的正常生命活动必不可少的元素是
A. Fe、Mn、Zn、Mg B. Cu、Zn、Mn、K
C. Mn、Zn、B、Cu D. Cu、N、S、Mo
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于细胞内化合物的叙述,正确的是
A. 蛋白质是生命活动的主要承担者
B. 淀粉是植物细胞壁的主要成分
C. DNA是一切生物的遗传物质
D. 染色体主要由RNA和蛋白质组成
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com