
【题目】火力发电在我国的能源利用中占较大比重,但是排放出的SO2会造成一系列环境和生态问题,直接排放含SO2的烟气会形成酸雨,危害环境.
(1)用化学方程式表示SO2形成硫酸型酸雨的反应: .
(2)工业上用Na2SO3溶液吸收烟气中的SO2 . 将烟气通入1.0molL﹣1的Na2SO3溶液,溶液pH不断减小.当溶液pH约为6时,吸收SO2的能力显著下降,应更换吸收剂. ①此时溶液中c(SO32﹣)的浓度是0.2molL﹣1 , 则溶液中c(HSO3﹣)是molL﹣1 .
②向pH约为6的吸收剂中通入足量的O2 , 可将其中的NaHSO3转化为两种物质,反应的化学方程式是 .
③某研究小组为探究提高含硫烟气中SO2的吸收效率的措施,模拟实验吸收含硫烟气,实验结果如图所示.则: , 有利于提高SO2的吸收效率.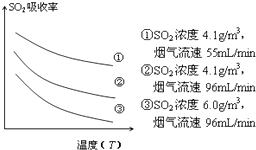
(3)工厂仓库存放的Na2SO3药品已部分被空气氧化,该化学小组想用已知浓度的酸性KMnO4溶液来确定其含量,具体步骤如下: 步骤i称取样品1.000g.
步骤ii将样品溶解后,完全转移到250mL容量瓶中,定容,充分摇匀.
步骤iii移取25.00mL样品溶液于250mL锥形瓶中,用0.01000molL﹣1 KMnO4标准溶液滴定至终点.
按上述操作方法再重复2次.
①写出步骤iii所发生反应的离子方程式;
②在配制0.01000molL﹣1 KMnO4溶液时若仰视定容,则最终测得药品中Na2SO3的含量(填“偏大”、“偏小”或“无影响”).
③某同学设计用下列仪器进行滴定实验(夹持部分略去),最合理的组合是(填字母).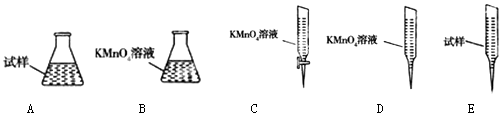
④滴定结果如下表所示:
滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
滴定前刻度/mL | 滴定后刻度/mL | ||
1 | 25.00 | 1.02 | 21.03 |
2 | 25.00 | 2.00 | 21.99 |
3 | 25.00 | 2.20 | 20.20 |
则该药品中Na2SO3的质量分数为 .
【答案】
(1)SO2+H2O?H2SO3;2H2SO3+O2=2H2SO4(或2SO2+O2?2SO3;SO3+H2O=H2SO4或2SO2+O2+2H2O=2H2SO4)
(2)1.6;2NaHSO3+O2═Na2SO4+H2SO4;降低含硫烟气温度(或流速)
(3)2MnO4﹣+5SO32﹣+6H+=2Mn2++5SO42﹣+3H2O;偏大;AC;63.00%
【解析】解:(1)SO2气体是酸性氧化物,可与水反应生成亚硫酸,亚硫酸可被氧化生成硫酸,二氧化硫具有还原性,在空气中经粉尘催化氧化为SO3 , SO3与水反应能生成硫酸,有关反应的化学方程式为:SO2+H2OH2SO3;2H2SO3+O2=2H2SO4 (或2SO2+O22SO3;SO3+H2O=H2SO4 或2SO2+O2+2H2O=2H2SO4),所以答案是:SO2+H2OH2SO3;2H2SO3+O2=2H2SO4 (或2SO2+O22SO3;SO3+H2O=H2SO4 或2SO2+O2+2H2O=2H2SO4);(2)①由Na2SO3+SO2+H2O═2NaHSO3 , c(SO32﹣)的浓度是0.2molL﹣1 , 则反应的Na2SO3溶液为1.0mol/L﹣0.2mol/L=0.8mol/L,由反应中的物质的量关系可知,生成的c(HSO3﹣)为0.8mol/L×2=1.6mol/L,所以答案是:1.6;②向pH约为6的吸收剂中通入足量的O2 , 发生氧化还原反应生成硫酸钠和硫酸,发生的反应为2NaHSO3+O2═Na2SO4+H2SO4 , 所以答案是:2NaHSO3+O2═Na2SO4+H2SO4;③根据图示可知:SO2的吸收效率随着温度的升高而降低,随流速的增大而降低,所以要提高含硫烟气中SO2的吸收效率,可以降低含硫烟气温度(或流速),所以答案是:降低含硫烟气温度(或流速);(3)①Na2SO3与酸性KMnO4溶液反应,亚硫酸根离子被氧化生成硫酸根离子,高锰酸根离子被还原为锰离子,配平反应的离子方程式:2MnO4﹣+5SO32﹣+6H+=2Mn2++5SO42﹣+3H2O,所以答案是:2MnO4﹣+5SO32﹣+6H+=2Mn2++5SO42﹣+3H2O;②在配制0.01000molL﹣1 KMnO4溶液时若仰视定容,KMnO4溶液浓度将偏低,需KMnO4溶液体积偏大,则最终测得药品中Na2SO3的含量偏大,所以答案是:偏大;③高锰酸钾具有强氧化性,能腐蚀碱式滴定管的橡皮管,应用酸式滴定管盛装,滴定时为便于观察颜色变化,滴定终点颜色由浅变深易于观察,应将高锰酸钾滴到待测液中,所以答案是:AC;④根据滴定结果:三次滴定所用标准溶液的体积分别为:21.03﹣1.02=20.01mL,21.99﹣2.00=19.99mL,20.20﹣2.20=18.00,第三次误差太大,需舍去;前两次实验所用标准溶液的体积平均值为20.00mL;25mLNa2SO3溶液中亚硫酸钠消耗的高锰酸钾的物质的量为:0.01mol/L×0.020L=0.0002mol, 根据反应方程式:
5SO32﹣+ | 2MnO4﹣+ | 6H+ | ═ | 5SO42﹣+ | 2Mn2++ | 3H2O |
5 | 2 | |||||
n | 0.0002mol |
n(SO32﹣)=0.0005mol,
250mL亚硫酸钠溶液中含有亚硫酸钠的物质的量为:0.0005mol× ![]() =0.005mol,
=0.005mol,
样品中含有的亚硫酸钠的质量为:m(SO32﹣)=126g/mol×0.005mol=0.63g,
ω(SO32﹣)= ![]() ×100%=63.00%,
×100%=63.00%,
所以答案是:63.00%.


科目:高中化学 来源: 题型:
【题目】同温同压下有两份体积相同的CO2和O3 , 关于它们的叙述正确的是( )
A.分子数之比是1:1
B.原子个数比是3:2
C.质子数比是12:11
D.密度之比是1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.热的浓HNO3能使蓝色石蕊试纸先变红后褪色
B.用HNO3和Na2S反应可以制得H2S气体
C.浓硫酸使蔗糖炭化,体现浓硫酸的的吸水性
D.热的浓硫酸可以用铁制器皿贮存
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是氮循环的一部分: 
(1)通常状况下,NO2的颜色是;
(2)反应①的化学方程式是;
(3)NO2易溶于水,并和水发生化学反应.该反应中,氧化剂是;
(4)化合物A的化学式是;
(5)治理汽车尾气的一种方法是用催化剂使NO与CO发生反应:2NO+2CO═2CO2+N2 . 当生成2mol N2时,被还原的NO为mol.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列水解反应离子方程式书写正确的是( )
A.CH3COOH+OH﹣CH3COO﹣+H2O
B.S2﹣+2H2OH2S+2OH﹣
C.CH3COOH+H2OCH3COO﹣+H3O+
D.CO32﹣+H2OHCO3﹣+OH﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份,向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只能被还原为NO气体)。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示。下列分析或结果错误的是
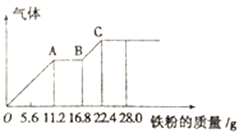
A. 原混合酸液中NO3-的物质的量为0.4mol B. AB段反应为2Fe3++Fe=3Fe2+
C. 溶液中最终溶质为FeSO4 D. c(H2SO4)为5mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某溶液中含有Na+、Ba2+、Fe3+三种阳离子,那么溶液中的阴离子可能是( )
A. SO42- B. Cl- C. OH- D. CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关叙述中正确的是
A. 向NaHSO4溶液中加入等浓度等体积的Ba(OH)2溶液:pH=13
B. NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度不同
C. 向醋酸溶液中加少量水稀释, 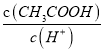 增大
增大
D. 向0.10mol/LNa2CO3溶液中通入少量CO2后:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com