
【题目】同温同压下有两份体积相同的CO2和O3 , 关于它们的叙述正确的是( )
A.分子数之比是1:1
B.原子个数比是3:2
C.质子数比是12:11
D.密度之比是1:1
科目:高中化学 来源: 题型:
【题目】如图实验装置用于验证某些物质的性质.在试管A中装入足量的固体NaHCO3.试回答下列问题:
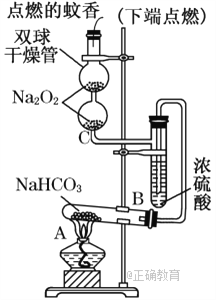
(1)在A试管内发生反应的化学方程式是____________________________________.
(2)B装置的作用是_______________________________________________________.
(3)在双球干燥管内发生反应的化学方程式为___________________________________.
(4)双球干燥管内观察到的实验现象是_________________________________________.上述实验现象说明________________________________________________________.
(5)若将干燥管内的Na2O2换成Na2O,则双球干燥管内观察到的实验现象是______________________________________________________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下pH=12的NaOH溶液中,由水电离出的c(OH﹣)是( )
A.1×10﹣2mol/L
B.1×10﹣7mol/L
C.1×10﹣12mol/L
D.1×10﹣14mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图1为某套实验装置的示意图,其中加热装置和部分药品等均已省略(装置Ⅰ和装置Ⅱ为气体发生装置)。
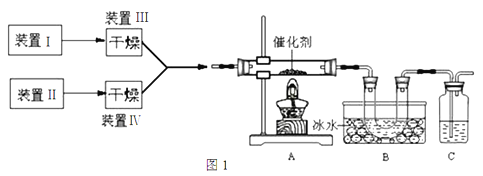
(1)甲同学用此装置(在A、B间增加一盛有浓硫酸的洗气瓶)
制备NO2并验证其性质。
①装置Ⅰ用于实验室制备NH3,装置Ⅱ制备过量O2。装置Ⅰ中发生反应的化学方程式为_____________________。
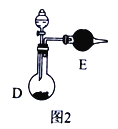
②也可以将制气体装置Ⅰ、Ⅱ、Ⅲ、Ⅳ合并为一个装置,如图2所示。若分液漏斗中盛装浓氨水,则D中的固体试剂为_______(填化学式),E中的试剂为____________。
(2)乙同学用此套装置合成SO3,B装置U形管中有固体出现。
①实验室可用铜和浓硫酸加热或硫酸和亚硫酸钠反应制取二氧化硫。 若用硫酸和亚硫酸钠反应制取3.36L(标准状况)二氧化硫,如果已有25.0%的亚硫酸钠(质量分数)被氧化为硫酸钠,则至少需称取该亚硫酸钠的质量为______g(保留一位小数)。
②现欲制得纯净干燥的SO3,若图1装置C中盛放NaOH溶液,则此装置中存在明显不足:
a.C中的水蒸气可能进入B中与SO3反应;b.____________________________________。
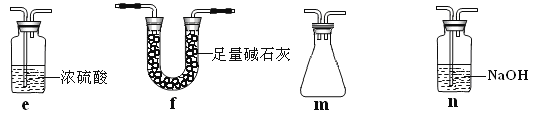
应如何改进:______________________________(从下图给出的实验装置中选择字母标号补充或替换,并用简要文字说明补充和替换的位置)。
(3)丙同学拟验证NO能被氨气还原并测算其转化率(装置Ⅰ、装置Ⅱ分别制取NO和NH3),将图1装置中A、B、C分别换成图5中装置Ⅴ、Ⅵ、Ⅶ。
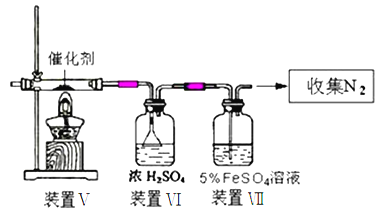
①写出氨气被NO氧化的化学方程式:___________________________。
②装置Ⅶ的作用可能是__________________________。
③若进入装置Ⅴ的NO共22.4L(已折算为标准状况,下同),氨气过量,最后收集到11.2LN2,则NO的转化率是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的一组是( )
①不溶于水的BaSO4是强电解质 ②可溶于水的酸都是强电解质 ③0.5mol/L的所有一元酸中氢离子浓度都是0.5mol/L ④熔融态的电解质都能导电。
A. ①③④ B. ②③④ C. ①④ D. ①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。
锌—锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)==Zn(OH)2(s)+Mn2O3(s),
下列说法错误的是( )
A. 电池工作时,锌失去电子
B. 电池工作时,电子由负极通过外电路流向正极
C. 电池正极的电极反应式为:2MnO2(s)+H2O(1)+2e-=Mn2O3(s)+2OH-(aq)
D. 外电路中每通过0.4mol电子,锌的质量理论上减小6.5g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述错误的是
A.常温下,可用铝槽车贮运浓硝酸
B.将氯气通入淀粉碘化钾溶液中,溶液变蓝
C.把铝箔放在酒精灯上加热,铝箔熔化但并不滴落
D.向蔗糖中加入浓硫酸,蔗糖变黑,体现了浓硫酸的吸水性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】火力发电在我国的能源利用中占较大比重,但是排放出的SO2会造成一系列环境和生态问题,直接排放含SO2的烟气会形成酸雨,危害环境.
(1)用化学方程式表示SO2形成硫酸型酸雨的反应: .
(2)工业上用Na2SO3溶液吸收烟气中的SO2 . 将烟气通入1.0molL﹣1的Na2SO3溶液,溶液pH不断减小.当溶液pH约为6时,吸收SO2的能力显著下降,应更换吸收剂. ①此时溶液中c(SO32﹣)的浓度是0.2molL﹣1 , 则溶液中c(HSO3﹣)是molL﹣1 .
②向pH约为6的吸收剂中通入足量的O2 , 可将其中的NaHSO3转化为两种物质,反应的化学方程式是 .
③某研究小组为探究提高含硫烟气中SO2的吸收效率的措施,模拟实验吸收含硫烟气,实验结果如图所示.则: , 有利于提高SO2的吸收效率.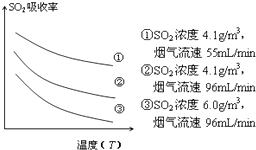
(3)工厂仓库存放的Na2SO3药品已部分被空气氧化,该化学小组想用已知浓度的酸性KMnO4溶液来确定其含量,具体步骤如下: 步骤i称取样品1.000g.
步骤ii将样品溶解后,完全转移到250mL容量瓶中,定容,充分摇匀.
步骤iii移取25.00mL样品溶液于250mL锥形瓶中,用0.01000molL﹣1 KMnO4标准溶液滴定至终点.
按上述操作方法再重复2次.
①写出步骤iii所发生反应的离子方程式;
②在配制0.01000molL﹣1 KMnO4溶液时若仰视定容,则最终测得药品中Na2SO3的含量(填“偏大”、“偏小”或“无影响”).
③某同学设计用下列仪器进行滴定实验(夹持部分略去),最合理的组合是(填字母).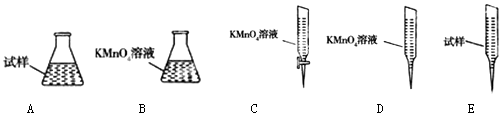
④滴定结果如下表所示:
滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
滴定前刻度/mL | 滴定后刻度/mL | ||
1 | 25.00 | 1.02 | 21.03 |
2 | 25.00 | 2.00 | 21.99 |
3 | 25.00 | 2.20 | 20.20 |
则该药品中Na2SO3的质量分数为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3=K2O+5Na2O+16N2↑。若有2molN2生成,则下列判断正确的是
A. 生成44.8LN2
B. 有0.125molKNO3被氧化
C. N2既是氧化产物又是还原产物
D. 转移电子的物质的量为10mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com