
����Ŀ��ijѧ����0.1000 molL��1KOHҺ�ζ�δ֪Ũ�ȵĴ��ᣬ������ֽ�Ϊ���¼����� A����ȡ20mL�������ע��ྻ����ƿ��������2��3��ָʾ��
B���ñ���Һ��ϴ�ζ���2��3��
C����ʢ�б���Һ�ļ�ʽ�ζ��̶ܹ��ã����ڵζ��ܼ���ʹ֮������Һ
D��ȡ��KOH���ʽ�ζ�������0���̶�����1��2cm
E������Һ������0����0������ijһ�̶ȣ����¶���
F������ƿ���ڵζ��ܵ����棬�ñ�KOH��Һ�ζ����յ㲢���µζ���Һ��Ŀ̶ȣ�
�ʹ�ʵ�������գ�
��1����ȷ���������˳���ǣ��������ĸ��д����
��2������B���������Ŀ������
��3������A�������֮ǰ�����ô���Һ��ϴ��ƿ��������յζ������Ӱ���� �� �����������С�������䡱��
��4��A�����У�ʹ�õ�ָʾ��Ϊ �� �жϵ���ζ��յ��ʵ�������ǣ���
��5����ͼ1Ϊijһ�μ�ʽ�ζ��ܵζ�ǰҺ�棬�����ֵΪmL��ͼ2Ϊ�ζ�����Һ�棬�εζ����̹�ʹ����mLKOH����Һ 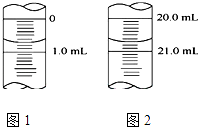
��6��Ϊ�궨ij������Һ��ȷŨ�ȣ���0.1000molL��1��NaOH��Һ��20.00mL������Һ���еζ������εζ�����NaOH��Һ��������£�
ʵ����� | 1 | 2 | 3 | 4 |
����NaOH��Һ�������mL�� | 20.05 | 20.00 | 18.80 | 19.95 |
��ô�����Һ��ȷŨ��Ϊ �� ������С�������λ��
���𰸡�
��1��B��D��C��E��A��F
��2����ֹ�ζ����ڱڵ�ˮ����Һϡ��
��3������
��4����̪��Һ�����������һ����Һʱ����ƿ����Һ����ɫ��Ϊdz��ɫ���Ұ���Ӳ���ɫ
��5��0.70��20.00
��6��0.1000mol?L��1
���������⣺��1���к͵ζ����ռ�©��ϴ�ӡ���ϴ��װҺ��ȡ����Һ����ָʾ�����ζ���˳�����������ȷ��˳��Ϊ��B��D��C��E��A��F�� ���Դ��ǣ�B��D��C��E��A��F����2���ζ���������ˮϴ���ḽ������������ˮ����ʹ����Һ��Ũ�ȼ�С������Ҫ�ñ���Һ��ϴ�ζ���2��3�Σ�
���Դ��ǣ���ֹ�ζ����ڱڵ�ˮ����Һϡ�ͣ���3����ƿ������ˮϴ�Ӻ�������ô���Һ��ϴ����ʹ��ƿ�����ʵ����ʵ����������V������ƫ����c�����⣩= ![]() ������֪�������c�����⣩ƫ�����Դ��ǣ�ƫ��4���������������ط�Ӧ���ɵĴ�����Լ��ԣ��÷�̪��ָʾ���������յ�ʱ�����������һ����Һʱ����ƿ����Һ����ɫ��Ϊdz��ɫ���Ұ���Ӳ���ɫ�����Դ��ǣ���̪��Һ�����������һ����Һʱ����ƿ����Һ����ɫ��Ϊdz��ɫ���Ұ���Ӳ���ɫ����5���ζ��ܵĿ̶����϶��¿̶�������Ϊ0.01mL����ͼ��֪�ζ�ǰ����Ϊ0.70mL���յ����Ϊ20.70mL���εζ����̹�ʹ����20.00mLKOH��Һ�����Դ��ǣ�0.70��20.00����6��������ʵ�����ݲ��ϴ����������ı�NaOH��Һ�����ƽ��ֵΪ20.00mL��
������֪�������c�����⣩ƫ�����Դ��ǣ�ƫ��4���������������ط�Ӧ���ɵĴ�����Լ��ԣ��÷�̪��ָʾ���������յ�ʱ�����������һ����Һʱ����ƿ����Һ����ɫ��Ϊdz��ɫ���Ұ���Ӳ���ɫ�����Դ��ǣ���̪��Һ�����������һ����Һʱ����ƿ����Һ����ɫ��Ϊdz��ɫ���Ұ���Ӳ���ɫ����5���ζ��ܵĿ̶����϶��¿̶�������Ϊ0.01mL����ͼ��֪�ζ�ǰ����Ϊ0.70mL���յ����Ϊ20.70mL���εζ����̹�ʹ����20.00mLKOH��Һ�����Դ��ǣ�0.70��20.00����6��������ʵ�����ݲ��ϴ����������ı�NaOH��Һ�����ƽ��ֵΪ20.00mL��
CH3COOH�� | NaOH |
1 | 1 |
C��CH3COOH����20.00m | 0.1000molL��1��20.00mL�� |
C��CH3COOH��=0.1000molL��1��
���Դ��ǣ�0.1000molL��1 ��
�����㾫����ͨ�������������к͵ζ��������к͵ζ�ʵ��ʱ��������ˮϴ���ĵζ������ñ�Һ��ϴ����װ��Һ�����ô���Һ��ϴ������ȡҺ�壻�ζ��ܶ���ʱ�ȵ�һ�����Ӻ��ٶ������۲���ƿ����Һ��ɫ�ĸı�ʱ���ȵȰ������ɫ�����Ϊ�ζ��յ㼴���Խ����⣮


 ��һ������Ԫͬ�����ؾ�ϵ�д�
��һ������Ԫͬ�����ؾ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼΪһЩ�������ʼ���ת����ϵ������FΪ����������������ijЩ���������ﷴӦ���ǹ�ҵұ�������ķ���֮һ�� AΪ��ɫ���壬BΪ����ɫ���壬CΪ��ɫҺ�壬E��JΪ��ɫ���嵥�ʣ�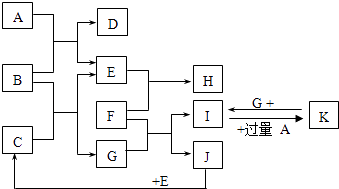
�Իش��������⣺
��1��д��B�Ļ�ѧʽ�� �� д��A�ĵ���ʽ��
��2��д��I��K�����ӷ���ʽ��
��3��д��F��Fe3O4�ڸ����·�Ӧ�Ļ�ѧ����ʽ��
��4����֪3g J��ȫȼ�շų�a kJ����������д����ʾJ��ȼ���ȵ��Ȼ�ѧ����ʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪A��g��+B��g��C��g��+D��s����Ӧ��ƽ�ⳣ�����¶ȵĹ�ϵ���£�
�¶ȡ� | 700 | 800 | 880 | 1000 | 1200 |
ƽ�ⳣ�� | 1.0 | 10.0 | 12.5 | 16.1 | 17.7 |
�ش��������⣺
��1���÷�Ӧ��ƽ�ⳣ������ʽK= �� ��H0�������������=������
��2��800��ʱ����һ��5L���ܱ������г���0.4molA��0.7molB������Ӧ��ʼ2mim��A��ƽ����Ӧ����Ϊ0.01molL��1min��1 �� ��2minʱc��A��=molL��1 �� C�����ʵ���Ϊmol��������һ��ʱ���Ӧ�ﵽƽ��ʱ���������г���0.4molA�����ٴδﵽƽ���A�İٷֺ������һ��ƽ����������������С�������䡱��
��3������ѡ��������Ϊ�жϷ�Ӧ�ﵽƽ��������� a��ѹǿ����ʱ��ı�
b��v��A����v��b��=1��1
c����λʱ��������A��B�����ʵ������
d��C�İٷֺ������ֲ���
��4��880�� ʱ����Ӧ C��g��+D��s��A��g��+B��g����ƽ�ⳣ����ֵΪ ��
��5��ij�¶�ʱ��ƽ��Ũ�ȷ�����ʽ��c��A����c��B��=c��C������ô�ʱ���¶�Ϊ�森
��6��ͼ��1000��ʱ������A�����ʵ����ı仯���ߣ�����ͼ�в������÷�Ӧ��1200��ʱA�����ʵ����ı仯����ͼ �� 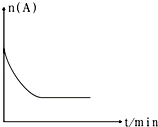
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������������л�����ǣ� ��
A.�軯�أ�KCN��
B.��Ȳ��C2H2��
C.����泥�NH4CNO��
D.̼���裨SiC��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͨ�����з�ɢϵʱ�����ܲ��������������ǣ�������
A. ���� B. ϡ���� C. ����ˮ D. ѪҺ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ����٤��������ֵ������˵����ȷ���ǣ� ��
A.0.2molAl������NaOH��Һ��Ӧ�����ɵ�H2������Ϊ0.3NA
B.�����£�1LpH=1��������Һ����ˮ�����H+������ĿΪ0.1NA
C.��״���£�0.1mol�ȷµ����Ϊ2.24L
D.11P4+60CuSO4+96H2O=20Cu3P+24H3SO4+60H2SO4��Ӧ�У�6molCuSO4���������ķ�����Ϊ1.1NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������У�����ʹ�������������Һ��ɫ���ǣ� ��
A.��Ȳ
B.�ױ�
C.��
D.��ϩ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ں��º��ݵ������н��з�ӦN2��g��+3H2��g�� ![]() 2NH3��g����������Ũ����0.1molL��1����0.06molL��1��2s����ô��0.06molL��1����0.024molL��1��Ҫ�ķ�Ӧʱ��Ϊ�� ��
2NH3��g����������Ũ����0.1molL��1����0.06molL��1��2s����ô��0.06molL��1����0.024molL��1��Ҫ�ķ�Ӧʱ��Ϊ�� ��
A.����1.8 s
B.����1.2 s
C.����1.8 s
D.��1.8 s
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com