
【题目】下列反应中,不属于取代反应的是( )
A. 苯与硝酸反应制取硝基苯
B. 乙烯与氯化氢反应制取氯乙烷
C. 乙醇与钠反应生成乙醇钠
D. 油脂在酸性条件下生成甘油和高级脂肪酸
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】将足量氯气通入盛有KI和KBr混合液的烧杯中,完全反应后,将溶液蒸干,灼烧,最后烧杯中剩余的固体是( )
A.KCl和I2
B.I2
C.KCl
D.KCl、Br2和I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示的图解表示构成生物体的元素、化合物及其作用,其中a、b、d、e代表小分子,A、B、E、F代表不同的分子量较大的物质,请据图回答下列问题:
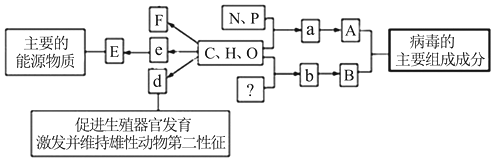
(1)e是细胞中主要的能源物质,被人称为“生命的燃料”,则e是___,E在植物细胞中主要是指_________,E在人体中主要分布于 ______ 细胞。
(2)在HIV(人类免疫缺陷病毒)中物质A的中文名称是___________,其基本组成单位a有______种。
(3)物质d是______;物质F是______,并且由于其储存能量多而且所占体积小,是生物体内重要的储能物质。等质量的物质F与物质E相比,物质F储存的能量多,从元素的含量上看,原因是 _____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)含氢原子8g的CH4所含原子总数是标况下____升H2所含原子总数的二倍。
(2)标况下,W g CO2与4.48 LH2的混合气体的总体积等于32g CH4的体积,求W=___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌钡白是一种白色颜料。工业上是由ZnSO4与BaS溶液混合而成:BaS+ZnSO4=ZnS↓+BaSO4↓。请根据以下工业生产流程回答有关问题。
Ⅰ.ZnSO4溶液的制备与提纯:

有关资料:a.菱锌矿的主要成分是ZnCO3,含少量SiO2、FeCO3、Cu2(OH)2CO3等;
b.Zn(OH)2与Al(OH)3相似,能溶于过量的NaOH溶液生成Na2ZnO2。
(1)若②中加入氧化剂为H2O2,写出离子反应方程式____________________________________。
(2)为了达到综合利用、节能减排的目的,上述流程步骤④中的CO2可以来自于步骤______(选填①、②、③、⑤)。
(3)滤渣2的主要成分为_______________________________。
(4)写出步骤④后产生滤渣3的离子反应方程式______________________________。
(5)滤液3中含碳粒子浓度大小的顺序为______________________________________。
Ⅱ.BaS溶液的制备:
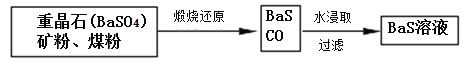
(6)写出煅烧还原的化学反应方程式__________________________________。
BaSO4和BaCO3的KSP相当,解释为什么BaCO3可溶于盐酸中而BaSO4难溶___________________。
Ⅲ.制取锌钡白:
(7)如果生产流程步骤⑤硫酸过量,则ZnSO4与BaS溶液混合制取锌钡白产生的后果是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2X为二元弱酸,常温下,0.1 mol/L的NaHX溶液中c(H+) > c(OH-),下列关系中一定正确的是
A. c(Na+) + c(H+) = c(HX-) + 2c(X2-) B. c(H+)·c(OH-) = 10-14 mol2·L-2
C. c(Na+) = c(X2-) + c(HX-) D. 溶液中pH = 1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于盐溶液呈酸碱性的说法错误的是( )
A. 盐溶液呈酸碱性的原因是破坏了水的电离平衡
B. ![]() 溶液呈酸性是由于溶液中
溶液呈酸性是由于溶液中![]()
C. 在![]() 溶液中,由水电离的
溶液中,由水电离的![]()
D. 水电离出的![]() 和
和![]() 与盐中弱酸阴离子或弱碱阳离子结合,造成盐溶液呈碱性或酸性
与盐中弱酸阴离子或弱碱阳离子结合,造成盐溶液呈碱性或酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组通过下列装置探究MnO2与FeCl3·6H2O能否反应产生Cl2。通过查阅资料,学习小组获知:FeCl3是一种共价化合物,熔点306℃,沸点315℃。

实验操作和现象:
操作 | 现象 |
点燃酒精灯,加热 | i.A中部分固体溶解,上方出现白雾 ii.稍后,产生黄色气体,管壁附着黄色液滴 iii.B中溶液变蓝 |
(1)现象i中的白雾是___________________,形成白雾的原因是________________。
(2)分析现象ii,该小组探究黄色气体的成分,实验如下:
a.直接加热FeCl3·6H2O,产生白雾和黄色气体。
b.将现象ii和a中的黄色气体通入KSCN溶液,溶液均变红。
通过该实验说明现象ii中黄色气体含有_______。
(3)除了氯气可使B中溶液变蓝外,该小组还提出其他两种可能的原因:
原因①:实验b检出的气体使之变蓝,反应的离子方程式是______________________________。
原因②:在酸性条件下,装置中的空气使之变蓝,反应的离子方程式是_______________。
(4)为进一步确认黄色气体中是否含有Cl2,小组提出两种方案,均证实了Cl2的存在。
方案1 | 在A、B间增加盛有某种试剂的洗气瓶C | B中溶液变为蓝色 |
方案2 | 将B中KI-淀粉溶液替换为NaBr溶液;检验Fe2+ | B中溶液呈浅橙红色;未检出Fe2+ |
①方案1的C中盛放的试荆是____________________。
②方案2中检验Fe2+的试剂是____________________。
③综合方案1、2的现象,说明方案2中选择NaBr溶液的依据是_____________________。
(5)将A中产物分离得到Fe2O3和MnCl2,A中产生Cl2的化学方程式是_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com