
【题目】用标准的盐酸滴定待测的氢氧化钠溶液时,可能使所测氢氧化钠溶液的浓度数值偏大的是( )
A.锥形瓶用蒸馏水洗净后没有干燥
B.碱式滴定管未用待测液润洗就直接注入待测氢氧化钠溶液
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始时仰视读数,滴定结束时俯视读数
科目:高中化学 来源: 题型:
【题目】Mg、Al和Cu组成的混合物进行下图所示实验,填写下列空白。
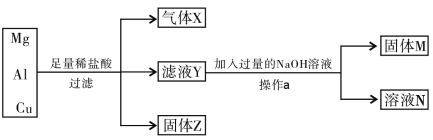
(1)气体X为______,固体Z为______。
(2)滤液Y中除H+外,还含有的阳离子为______和______。
(3)溶液N为______,由滤液Y生成溶液N的离子反应方程式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、某温度下,HNO2和CH3COOH的电离常数分别为5.0×10-4和1.7×10-5。将pH和体积均相同的两种酸溶液分别加水稀释,其pH随加水体积的变化如图所示。

(1)曲线Ⅰ代表____溶液(填“HNO2”或“CH3COOH”,下同)。
(2)a点时,物质的量浓度较大的是______溶液。相同体积a点的两溶液分别与NaOH恰好中和后,溶液中n(Na+)较少的是_____。
(3)b、c两点溶液中水的电离程度较大的是___ (填“b”或“c”)。
(4)CH3COOH的稀释过程中,下列说法正确的是___ (填编号)。
a.CH3COOH的电离常数增大
b.H+的物质的量减小
c. ![]() 保持不变
保持不变
d. CH3COOH的电离程度增大,溶液的导电能力增强
Ⅱ、25℃,两种酸的电离平衡常数如表。
|
| |
H2A | 4.4×10-7 | 4.7×10-11 |
H2B | 1.3×10-7 | 7.1×10-15 |
(5)HA-的电离平衡常数表达式K =_______。
(6)0.10 molL-1 NaHB溶液中H+、OH-、Na+、HB-的浓度由大到小的顺序为_______。
(7)等浓度的四种溶液:a. Na2A、b. NaHA、c. Na2B、d. NaHB的pH由大到小顺序是_______(填字母)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是中学化学中常见的有机物转化关系(部分相关物质和反应条件已略去)。
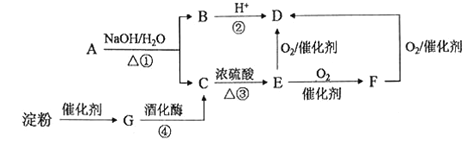
(1)写出E的官能团名称:____________;
(2)③的反应类型为 _______________;
(3)写出反应①的化学方程式:__________________________________;
(4)下列有关上述有机物的说法正确的是____________________。
A.将绿豆大小的钠块投入C中,钠块浮于液面上,并有大量气泡产生
B.可用新制Cu(OH)2鉴别C、D、F三种无色液体(实验过程可加热)
C.G能够发生酯化、水解、氧化、加成等反应
D.相同物质的量的C、E充分燃烧时消耗等量的氧气
查看答案和解析>>
科目:高中化学 来源: 题型:
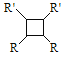
【题目】具有抗菌作用的白头翁素衍生物H的合成路线如下图所示:
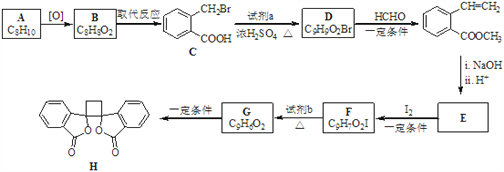
已知:i.RCH2Br ![]() R﹣HC═CH﹣R′
R﹣HC═CH﹣R′
ii.R﹣HC═CH﹣R′![]()
![]()
iii.R﹣HC═CH﹣R′![]()
(以上R、R'、R'代表氢、烷基或芳基等)
(1)A属于芳香烃,其名称是_______________________。
(2)D的结构简式是_______________________________。
(3)由F生成G的反应类型是________________________________________。
(4)由E与I2在一定条件下反应生成F的化学方程式是_____________________;此反应同时生成另外一个有机副产物且与F互为同分异构体,此有机副产物的结构简式是_______________________________。
(5)下列说法正确的是___________(选填字母序号)。
A. G存在顺反异构体
B. 由G生成H的反应是加成反应
C. 1 mol G最多可以与1 mol H2发生加成反应
D. 1 mol F或1 mol H与足量NaOH溶液反应,均消耗2 molNaOH
(6)以乙烯为起始原料,结合已知信息选用必要的无机试剂合成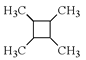 写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。___________________
写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。___________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积均为1 L的三个密闭容器中,分别放入铁粉并充入1 mol CO,控制在不同温度下发生反应:Fe(s)+5CO(g) ![]() Fe(CO)5(g),当反应进行到5min时,测得CO的体积分数与温度的关系如图所示。下列说法一定正确的是( )
Fe(CO)5(g),当反应进行到5min时,测得CO的体积分数与温度的关系如图所示。下列说法一定正确的是( )

A. 反应进行到5min时,b容器中v(正)=v(逆)
B. 正反应为吸热反应,平衡常数:K(T1)>K(T2)
C. b中v(正)大于a中v(逆)
D. 达到平衡时,a、b、c中CO的转化率为b>c>a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】改变0.1![]() 二元弱酸
二元弱酸![]() 溶液的pH,溶液中的
溶液的pH,溶液中的![]() 、
、![]() 、
、![]() 的物质的量分数
的物质的量分数![]() 随pH的变化如图所示[已知
随pH的变化如图所示[已知 ]。
]。

下列叙述错误的是( )
A. pH=1.2时, ![]()
B. ![]()
C. pH=2.7时, ![]()
D. pH=4.2时, ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为CaF2、H3BO3(层状结构,层内的H3BO3分子通过氢键结合)、金属铜三种晶体的结构示意图,请回答下列问题:


图Ⅲ 铜晶体中铜原子堆积模型
(1)图Ⅰ所示的CaF2晶体中与Ca2+最近且等距离的F-数为________________,图Ⅲ中未标号的铜原子形成晶体后周围最紧邻的铜原子数为__________________________________。
(2)图Ⅱ所示的物质结构中最外能层已达8电子结构的原子是________,H3BO3晶体中B原子个数与极性键个数比为____________。
(3)金属铜具有很好的延展性、导电性、传热性,对此现象最简单的解释是用________理论。
(4)三种晶体中熔点最低的是________(填化学式),其晶体受热熔化时,克服的微粒之间的相互作用为____________________________________________________________。
(5)已知两个距离最近的Ca2+核间距离为a×10-8cm,结合CaF2晶体的晶胞示意图,CaF2晶体的密度为_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在容积固定的V L密闭容器中加入n mol A.2n mol B,发生反应:A(g)+2B(g) ![]() 2C(g) ΔH<0,反应达平衡后测得平衡常数为K,此时A的转化率为x。
2C(g) ΔH<0,反应达平衡后测得平衡常数为K,此时A的转化率为x。
(1)一段时间后上述反应达到平衡。则下列说法中正确的是________(填字母)。
A.物质A.B的转化率之比为1∶2
B.起始时刻和达到平衡后容器中的压强之比为3n∶(3n-nx)
C.当2v正(A)=v逆(B)时,反应一定达到平衡状态
D.充入惰性气体(如Ar),平衡向正反应方向移动
(2)K和x的关系满足K=________。在保证A浓度不变的情况下,扩大容器的体积,平衡______(填字母)。
A.向正反应方向移动 B.向逆反应方向移动 C.不移动
(3)该反应的逆反应速率与时间的关系如图所示。

①由图可知,反应在t1.t3.t7时都达到了平衡,而t2.t8时都改变了一种条件,试判断改变的条件:t2时_______________________;t8时_________________________。
②t2时平衡向___________________(填“正反应”或“逆反应”)方向移动。
③若t4时降压,t5时达到平衡,t6时增大反应物的浓度,请在图中画出t4~t6时逆反应速率与时间的关系曲线__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com