

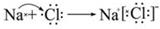 ,故答案为:
,故答案为: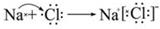 .
.


科目:高中化学 来源: 题型:
| A、硝酸是易挥发的强酸 |
| B、纯碱溶液能使酚酞溶液品红色 |
| C、CO是无色难溶于水的气体 |
| D、Fe3+可以与KSCN溶液反应生成血红色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、△H1<△H2 |
| B、△H1=△H2 |
| C、△H1>△H2 |
| D、无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①② | B、②③ | C、①④ | D、③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
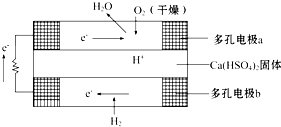 如图是某固体酸燃料电池基本结构示意图,其中以Ca(HSO4)2固体为电解质传递H+,电池总反应式为:2H2+O2═2H2O,下列有关说法不正确的是( )
如图是某固体酸燃料电池基本结构示意图,其中以Ca(HSO4)2固体为电解质传递H+,电池总反应式为:2H2+O2═2H2O,下列有关说法不正确的是( )| A、H2通过多孔电极时能增大H2的接触面积,加快反应 |
| B、a极上的电极反应式为:O2+2H2O+4e-═4OH- |
| C、每转移0.1 mol电子,消耗标准状况下的H2 1.12 L |
| D、H+由b极通过固体酸电解质传递到a极 |
查看答案和解析>>
科目:高中化学 来源: 题型:
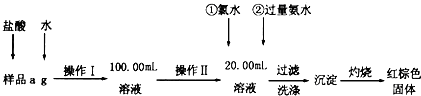
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、KMn04作氧化剂 |
| B、该反应不属于离子反应 |
| C、氮元素被还原 |
| D、当反应中转移10 mol电子时,生成lmol MnS04 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、硫酸铵溶液显酸性:NH
| ||
| B、向AgCl悬浊液中加Na2S溶液,白色沉淀变成黑色:2Ag++S2-=Ag2S↓ | ||
| C、将足量CO2通入Na2SiO3溶液中,出现白色沉淀:SiO32-+CO2+H2O=H2SiO3↓+CO32- | ||
| D、向NaAlO2溶液中加入NaHCO3溶液,出现白色沉淀:AlO2-+HCO3-+H2O=Al(OH)3↓+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com