
【题目】在500 ℃时,2SO2(g)+O2(g) ![]() 2SO3(g)正向是放热反应的体系中,只改变下列条件,请把影响结果填入表中。
2SO3(g)正向是放热反应的体系中,只改变下列条件,请把影响结果填入表中。
改变条件 | 正反应速率 | 逆反应速率 | 平衡移动情况 |
(1)增大O2的浓度 | |||
(2)增大SO2的浓度 | |||
(3)减小SO3的浓度 | |||
(4)增大压强 | |||
(5)升高温度 | |||
(6)加入催化剂 | |||
(7)体积不变充入氖气 |
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
【题目】在一定条件下,3molX与3molY在恒容密闭容器中发生反应X(g)+3Y(g)![]() 2Z(g),△H=-Q kJ·molˉ1(Q>0)下列说法正确的是
2Z(g),△H=-Q kJ·molˉ1(Q>0)下列说法正确的是
A. 达到平衡时,反应放出QkJ热量
B. 反应一段时间后,X与Y的物质的量之比仍为1:1
C. X的体积分数不变,说明反应已达到平衡状态
D. 达到平衡后,若向平衡体系中充入氦气,Z的反应速率不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科研小组设计出利用工业废酸(10%H2SO4)来堆浸某废弃的氧化铜锌矿的方案,实现废物综合利用,方案如图所示. 
已知:各离子开始沉淀及完全沉淀时的pH如下表所示.
离子 | 开始沉淀时的pH | 完全沉淀时的pH |
Fe2+ | 6.34 | 9.7 |
Fe3+ | 1.48 | 3.2 |
Zn2+ | 6.2 | 8.0 |
请回答下列问题:
(1)氧化铜锌矿中含有少量的CuS和ZnS,在H2SO4的作用下ZnS可以溶解而CuS不溶,则相同温度下:Ksp(CuS)Ksp(ZnS)(选填“>”“<”或“=”).
(2)物质A可使用下列物质中的 .
A.KMnO4
B.O2
C.H2O2
D.Cl2
(3)除铁过程中加入氨水的目的是调节溶液的pH,pH应控制在范围之间.
(4)物质B可直接用作氮肥,则B的化学式是 .
(5)除铁后得到的Fe(OH)3可用KClO溶液在碱性环境将其氧化得到一种高效的多功能水处理剂﹣﹣K2FeO4 , 写出该反应的离子方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有AlCl3和MgSO4混合溶液,向其中不断加入0.1mol/L 的NaOH溶液,得到沉淀的量与加入NaOH溶液的体积如图所示,原溶液中Cl﹣与SO42﹣的物质的量之比为( ) 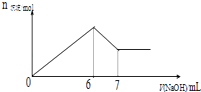
A.2:1
B.2:3
C.6:1
D.3:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅及其化合物可用于蓄电池、耐酸设备及X射线防护材料等,回答下列问题:
(1)铅是碳的同族元素,比碳多4个电子层,铅在元素周期表的位置是第①周期、第②族;PbO2的酸性比CO2的酸性③(填“强”或“弱”).
(2)PbO2与浓盐酸共热生成黄绿色气体,反应的化学方程式为④ .
(3)PbO2可由PbO与次氯酸钠溶液反应制得,反应的离子方程式为⑤;PbO2也可以通过石墨为电极,Pb(NO3)2与Cu(NO3)2的混合溶液为电解液电解制取,阳极发生的电极反应式为⑥ , 阴极上观察到得现象是⑦;若电解液中不加入Cu(NO3)2 , 阴极发生的电极反应式为⑧ , 这样做的主要缺点是⑨ .
(4)PbO2在加热过程发生分解的失重曲线如图所示,已知失重曲线上的a点为样品失重4.0%(即 ![]() ×100%)的残留固体.若a点固体组成表示为PbOx或mPbO2nPbO,列式计算x值和m:n值⑩ .
×100%)的残留固体.若a点固体组成表示为PbOx或mPbO2nPbO,列式计算x值和m:n值⑩ . 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若用AG来表示溶液的酸度,其表达式为:AG=lg[![]() ]。298 K时,用0.1 mol/L的盐酸溶液滴定10 mL 0.1 mol/L 的MOH溶液,滴定曲线如图所示:下列说法正确的是( )
]。298 K时,用0.1 mol/L的盐酸溶液滴定10 mL 0.1 mol/L 的MOH溶液,滴定曲线如图所示:下列说法正确的是( )
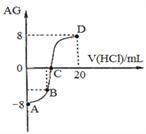
A. 该滴定实验最好选择酚酞作为指示剂
B. C点时加入盐酸溶液的体积等于10 mL
C. 滴定过程中从A点到D点,溶液中水的电离程度先逐渐减小,后逐渐增大
D. 若B点加入的盐酸溶液体积为5mL,则所得溶液中:c(M+)+2c(H+)=c(MOH)+2c(OH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2.5L的恒容密闭容器中发生如下反应:CO2(g)+H2S(g)![]() COS(g)+H2O(g)
COS(g)+H2O(g)
实验 | 温度/K | 起始物质的量/mol | 平衡物质的量/mol | 平衡常数 | |
CO2 | H2S | H2O | |||
I | 607 | 0.11 | 0.41 | 0.01 | |
II | 607 | 0.22 | 0.82 | ||
III | 620 | 0.1 | 0.4 | 6.74×10-3 | |
下列说法不正确的是( )
A. 该反应正反应为吸热反应
B. 607K时,把物质的量均为0.1mol四种反应物加入该反应器中,反应将向正反应方向进行
C. 实验Ⅱ达到平衡时容器中COS的物质的量为0.02mol
D. 实验Ⅲ中,无论是开始还是至化学平衡状态,混合气体的密度始终不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是( )
A. 2NO(g)+2CO(g)=N2(g)+2CO2(g)在常温下能自发进行,则该反应的△H>0
B. 对于乙酸与乙醇的酯化反应(△H<0),加入少量浓硫酸并加热,该反应的反应速率和平衡常数均增大
C. CH3COOH 溶液加水稀释后,溶液中![]() 的值增大
的值增大
D. Na2CO3溶液中加入少量Ca(OH)2 固体,CO32-水解向左移动,溶液的pH 增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】700 ℃时,向容积为2 L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g) ![]() CO2(g)+H2(g) 反应过程中测定的部分数据见下表(表中t2>t1):
CO2(g)+H2(g) 反应过程中测定的部分数据见下表(表中t2>t1):
反应时间/min | n(CO)/mol | n(H2O)/mol |
0 | 1.20 | 0.60 |
t1 | 0.80 | |
t2 | 0.20 |
下列说法正确的是 ( )
A. 反应在t1 min内的平均速率为v(H2)=![]() mol·L-1·min-1
mol·L-1·min-1
B. 保持其他条件不变,起始时向容器中充入0.60 mol CO和1.20 mol H2O,达到平衡时n(CO2)=0.30 mol
C. 保持其他条件不变,向平衡体系中再通入0.20 mol H2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数增大
D. 温度升高至800 ℃,上述反应平衡常数为0.64,则正反应为吸热反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com