
����Ŀ��һ���¶��£���2.5L�ĺ����ܱ������з������·�Ӧ��CO2(g)+H2S(g)![]() COS(g)��H2O(g)
COS(g)��H2O(g)
ʵ�� | �¶�/K | ��ʼ���ʵ���/mol | ƽ�����ʵ���/mol | ƽ�ⳣ�� | |
CO2 | H2S | H2O | |||
I | 607 | 0.11 | 0.41 | 0.01 | |
II | 607 | 0.22 | 0.82 | ||
III | 620 | 0.1 | 0.4 | 6.74��10-3 | |
����˵������ȷ������ ��
A. �÷�Ӧ����ӦΪ���ȷ�Ӧ
B. 607Kʱ�������ʵ�����Ϊ0.1mol���ַ�Ӧ�����÷�Ӧ���У���Ӧ��������Ӧ�������
C. ʵ�����ﵽƽ��ʱ������COS�����ʵ���Ϊ0.02mol
D. ʵ�����У������ǿ�ʼ��������ѧƽ��״̬�����������ܶ�ʼ�ղ���
���𰸡�B
�����������������A��CO2(g)+H2S(g)![]() COS(g)+H2O(g)���ڷ�Ӧ��ʼ��n(CO2)= 0.11mol��n(H2S)=0.41mol�� n(H2O)=0���ڷ�Ӧ������ˮ�ı�����ʵ�����n(H2O)=0.01mol������ݷ���ʽ��ϵ����ϵ��֪��n(CO2)= n(COS)= n(H2S)= n(H2O)=0.01mol������ƽ��ʱ�������ʵ����ʵ����ֱ���n(CO2)=0.1mol��n(H2S)= 0.4mol��n(COS)= n(H2O)=0.01mol�����ڷ�Ӧǰ��ϵ������ȣ����Դ�ʱK= [c(COS)��c(H2O)] ��[c(CO2)�� c(H2S)] ="(0.01��0.01)��(0.1��0.4)" =0.0025��6.74��10-3 ���¶����ߣ�K����˵�������¶ȣ���ѧƽ��������Ӧ�����ƶ�������ƽ���ƶ�ԭ���������¶ȣ���ѧƽ�������ȷ�Ӧ�����ƶ������Ը÷�Ӧ������Ӧ�����ȷ�Ӧ��A��ȷ�� B������ѡ��A������֪607Kʱ�÷�Ӧ��ƽ�ⳣ��ΪK=2.50��10-3 ���������ʵ�����Ϊ0.1mol���ַ�Ӧ�����÷�Ӧ���У���Qc��(0.1��0.1)��(0.1��0.1)��1>0.0025�����Է�Ӧ������У�V��>V����B����C���÷�Ӧ�Ƿ�Ӧǰ�����������ȵķ�Ӧ������ѹǿ����ѧƽ�ⲻ�����ƶ������Դﵽƽ��ʱ������COS�����ʵ���Ϊ0.02mol��C��ȷ��D��ʵ�����У������ǿ�ʼ��������ѧƽ��״̬�����ڷ�Ӧǰ����������ʵ������䣬������������䣬���Ի��������ܶ�ʼ�ղ��䣬D��ȷ����ѡB��
COS(g)+H2O(g)���ڷ�Ӧ��ʼ��n(CO2)= 0.11mol��n(H2S)=0.41mol�� n(H2O)=0���ڷ�Ӧ������ˮ�ı�����ʵ�����n(H2O)=0.01mol������ݷ���ʽ��ϵ����ϵ��֪��n(CO2)= n(COS)= n(H2S)= n(H2O)=0.01mol������ƽ��ʱ�������ʵ����ʵ����ֱ���n(CO2)=0.1mol��n(H2S)= 0.4mol��n(COS)= n(H2O)=0.01mol�����ڷ�Ӧǰ��ϵ������ȣ����Դ�ʱK= [c(COS)��c(H2O)] ��[c(CO2)�� c(H2S)] ="(0.01��0.01)��(0.1��0.4)" =0.0025��6.74��10-3 ���¶����ߣ�K����˵�������¶ȣ���ѧƽ��������Ӧ�����ƶ�������ƽ���ƶ�ԭ���������¶ȣ���ѧƽ�������ȷ�Ӧ�����ƶ������Ը÷�Ӧ������Ӧ�����ȷ�Ӧ��A��ȷ�� B������ѡ��A������֪607Kʱ�÷�Ӧ��ƽ�ⳣ��ΪK=2.50��10-3 ���������ʵ�����Ϊ0.1mol���ַ�Ӧ�����÷�Ӧ���У���Qc��(0.1��0.1)��(0.1��0.1)��1>0.0025�����Է�Ӧ������У�V��>V����B����C���÷�Ӧ�Ƿ�Ӧǰ�����������ȵķ�Ӧ������ѹǿ����ѧƽ�ⲻ�����ƶ������Դﵽƽ��ʱ������COS�����ʵ���Ϊ0.02mol��C��ȷ��D��ʵ�����У������ǿ�ʼ��������ѧƽ��״̬�����ڷ�Ӧǰ����������ʵ������䣬������������䣬���Ի��������ܶ�ʼ�ղ��䣬D��ȷ����ѡB��


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���ݻ����ܱ������н��з�Ӧ��N2(g)+3H2(g)![]() 2NH3(g)����֪��Ӧ������ijһʱ��N2��H2��NH3��Ũ�ȷֱ�Ϊ0.1mol/L��0.3mol/L��0.2mol/L������Ӧ�ﵽƽ��ʱ�����ܴ��ڵ�������
2NH3(g)����֪��Ӧ������ijһʱ��N2��H2��NH3��Ũ�ȷֱ�Ϊ0.1mol/L��0.3mol/L��0.2mol/L������Ӧ�ﵽƽ��ʱ�����ܴ��ڵ�������
A. N2Ϊ0.2mol/L��H2Ϊ0.6mol/L B. N2Ϊ0.15mol/L
C. N2��H2��Ϊ0.18 mol/L D. NH3Ϊ0.4mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����е��ʻ������ʵ�������ȷ���ǣ� ��
A.NaHSO4ˮ��Һ������
B.NO2����ˮʱ����������ԭ��Ӧ
C.SiO2���ᡢ�������Ӧ
D.Fe������Cl2��ȼ������FeCl2��FeCl3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����500 ��ʱ��2SO2(g)��O2(g) ![]() 2SO3(g)�����Ƿ��ȷ�Ӧ����ϵ�У�ֻ�ı��������������Ӱ����������С�
2SO3(g)�����Ƿ��ȷ�Ӧ����ϵ�У�ֻ�ı��������������Ӱ����������С�
�ı����� | ����Ӧ���� | �淴Ӧ���� | ƽ���ƶ���� |
��1������O2��Ũ�� | |||
��2������SO2��Ũ�� | |||
��3����СSO3��Ũ�� | |||
��4������ѹǿ | |||
��5�������¶� | |||
��6��������� | |||
��7���������������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڳ�ѹ��100�������£����Ҵ�����Ϊ������Ȼ�����ϩ�����������ϣ��õ��������V L��������ȫȼ�գ���������ͬ�����µ�������������� ��
A��2V L B��2.5V L C��3V L D��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ̽��ij��ʯ����������Ԫ�أ�����ɺ����ʣ���Ʋ��������ʵ�飺
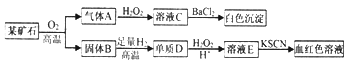
��ش���1��ij��ʯ�����Ԫ��Ϊ__________(��Ԫ�ط��ű�ʾ)��
��2������A��H2O2��Һ��Ӧ�Ļ�ѧ����ʽ��________________��
��3��д��D��E�����ӷ���ʽ____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪1molH2(g)��1molBr2(g)��ȫ��Ӧ����2molHBr(g)�ų�102kJ������������ʽΪ��H2(g)��Br2(g)��2HBr(g)����֪��
H2(g) | Br2(g) | HBr(g) | |
1mol�����еĻ�ѧ������ʱ��Ҫ���յ�������kJ�� | 436 | a | 369 |
�����aΪ
A. 200 B. 260 C. 404 D. 230
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����( )
A. KClO3��SO3����ˮ���ܵ��磬��KClO3��SO3Ϊ�����
B. ��Cr2O72- + H2O![]() 2CrO42-+ 2H+ ��ƽ����ϵ�еμ�10��20��6mol/LNaOH��Һ��ɫ�ɳ�ɫ���ɫ
2CrO42-+ 2H+ ��ƽ����ϵ�еμ�10��20��6mol/LNaOH��Һ��ɫ�ɳ�ɫ���ɫ
C. 500�桢30MPa�£���0.5mol N2��1.5molH2�����ܱյ������г�ַ�Ӧ����NH3(g)������19.3kJ�����Ȼ�ѧ����ʽΪ N2(g)��3H2(g)![]() 2NH3(g) ��H=��38.6kJ��mol��1
2NH3(g) ��H=��38.6kJ��mol��1
D. ��֪��
���ۼ� | C��C | C=C | C��H | H��H |
����/ kJ��mol-1 | 348 | 610 | 413 | 436 |
����Լ������Ӧ ����HΪ��384 kJ��mol-1
����H��384 kJ��mol-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ����������ϡ���ᷴӦ�������˱�״����4.48L������
��1�����㷢����Ӧ���������ʵ���Ϊ���٣���д��������̣�
��2�������������Ũ��Ϊ0.5molL��1 �� ��������Ҫ��������Ϊ����
��3��������ϡ���������ܶ�Ϊ1.19g/cm3����������Ϊ36.5%��Ũ����ϡ�͵õ������Ũ�����������Ũ����molL��1 ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com