
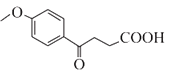
【题目】化合物H是![]() 受体拮抗剂
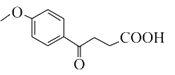
受体拮抗剂![]() 的中间体,Nakamura等人设计制备H的合成路线如图所示:
的中间体,Nakamura等人设计制备H的合成路线如图所示:

已知:Ⅰ.![]()
![]()
![]() ;
;
Ⅱ.![]() 。
。
回答下列问题:
(1)B中含氧官能团的名称为______________。
(2)F的分子式为![]() ,则F的结构简式为___________。
,则F的结构简式为___________。
(3)②⑤的反应类型分别为____________、____________。
(4)反应①的化学方程式为________________。
(5)碳原子上连有4个不同的原子或基团时,该碳称为手性碳,写出化合物H与足量![]() 发生加成反应的产物的结构简式,并用星号(*)标出其中的手性碳:________________。
发生加成反应的产物的结构简式,并用星号(*)标出其中的手性碳:________________。
(6)Q与C互为同分异构体,Q遇![]() 溶液发生显色反应,且苯环上连有两个取代基,
溶液发生显色反应,且苯环上连有两个取代基,![]() 与足量
与足量![]() 溶液反应最多产生
溶液反应最多产生![]() ,则Q的同分异构体有_______种(不含立体异构);其中核磁共振氢谱有6组吸收峰的结构简式为____________(任写一种)。
,则Q的同分异构体有_______种(不含立体异构);其中核磁共振氢谱有6组吸收峰的结构简式为____________(任写一种)。
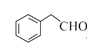
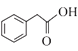
(7)参照上述合成路线和信息,设计以苯乙醛为原料(其他试剂任选)制备![]() 的合成路线:____________。
的合成路线:____________。
【答案】羧基、羰基、醚键  还原反应 取代反应
还原反应 取代反应 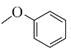 +
+![]()
![]()
 36
36 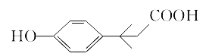 或
或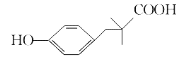
![]()
![]()

![]()
![]()
【解析】
根据已知信息I![]()
![]()
![]() ,可知D反应生成E过程中,D分子结构中的羰基转化为羟基,E的结构简式为
,可知D反应生成E过程中,D分子结构中的羰基转化为羟基,E的结构简式为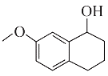 ;结合信息II
;结合信息II![]() ,可知G生成H的过程中,-CN转化为-COOH,则G的结构简式为
,可知G生成H的过程中,-CN转化为-COOH,则G的结构简式为 ;E与SOCl2反应生成F,F与NaCN反应生成G,又F的分子式为
;E与SOCl2反应生成F,F与NaCN反应生成G,又F的分子式为![]() ,则F的结构简式为
,则F的结构简式为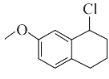
由以上分析知,E为 ,F为
,F为 ,G为
,G为 ,
,
(1)B中含氧官能团为醚键、羧基、羰基,故答案为:羧基、羰基、醚键;
(2)F的结构简式为 ,故答案为:
,故答案为: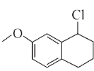 ;
;
(3)反应②中,B的碳氧双键变为C中的C-H饱和碳原子,为还原反应;反应⑤中,E中的羟基变为F中的Cl原子,为取代反应,故答案为:还原反应;取代反应;
(4)根据流程可知,反应①的化学方程式为 +
+![]()
![]()
 ,故答案为:
,故答案为: +
+![]()
![]()
 ;
;
(5)H与足量![]() 加成的产物为
加成的产物为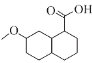 ,碳原子上连有4个不同的原子或基团时,该碳称为手性碳,则该结构中含有4个手性碳原子,分别为
,碳原子上连有4个不同的原子或基团时,该碳称为手性碳,则该结构中含有4个手性碳原子,分别为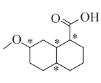 ,故答案为:
,故答案为: ;
;
(6)Q遇![]() 溶液发生显色反应,说明苯环上含有酚羟基
溶液发生显色反应,说明苯环上含有酚羟基![]() ;
;![]() 与足量
与足量![]() 溶液反应最多产生
溶液反应最多产生![]() ,说明含有一个羧基
,说明含有一个羧基![]() ;苯环上连有两个取代基,说明羧基连在丁基上,丁基的结构有4种:
;苯环上连有两个取代基,说明羧基连在丁基上,丁基的结构有4种: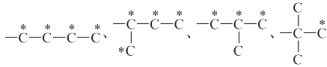 ,
,![]() 连在带星号的碳原子上,有12种,两个取代基在苯环上有邻、间、对三种位置,故满足条件的Q的同分异构体有
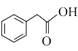
连在带星号的碳原子上,有12种,两个取代基在苯环上有邻、间、对三种位置,故满足条件的Q的同分异构体有![]() 种,其中核磁共振氢谱有6组吸收峰的结构简式为
种,其中核磁共振氢谱有6组吸收峰的结构简式为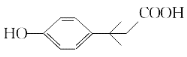 或
或 ,
,
故答案为:36;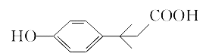 或
或 ;
;
(7)苯乙醛先氧化为苯乙酸,再参考![]() 的条件,生成
的条件,生成 ,
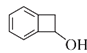
, 发生消去反应生成目标产物,故答案为:
发生消去反应生成目标产物,故答案为:
![]()
![]()

![]()

![]()
 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】当今环境问题越来越受到人们的重视。汽车尾气中含有较多的NO和CO,两种气体均会使人体中毒。处理大气中的污染物,打响“蓝天白云”保卫战是当前的重要课题。请回答下列问题
(1)用还原法将NO转化为无污染的物质。已知:
2C(s)+O2(g)![]() 2CO △H1=-221.0KJ/mol
2CO △H1=-221.0KJ/mol
N2(g)+O2(g)![]() 2NO △H2=+180.5KJ/mol
2NO △H2=+180.5KJ/mol
2NO+C(s)![]() CO2(g)+N2(g) △H3=-573.75KJ/mol
CO2(g)+N2(g) △H3=-573.75KJ/mol
请写出CO与NO生成无污染气体CO2与N2的热化学方程式_______________________。
(2)在一定温度下,向甲、乙、丙三个恒容密闭容器中加入一定量的NO和足量的焦炭,反应过程中测得各容器中c(NO)(mol/L)随时间(s)的变化如下表。
已知:三个容器的反应温度分别为T甲= 500℃、T乙= 500℃、T丙= a℃
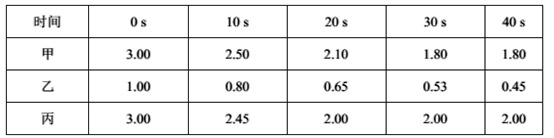
甲容器中,该反应的平衡常数K=_______。丙容器的反应温度a _______500℃(填“”、“<”或“=”),理由是_______________________________。
(3)某研究性小组在实验室以Ag-ZSM-5为催化剂,测得NO转化为N2的转化率随温度变化情况如图所示。
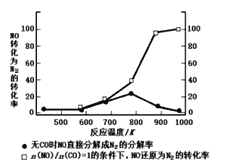
①若不使用CO,温度超过775K,发现NO的分解率降低,其可能的原因为_________。
②在n(NO)/n(CO)=1的条件下,为更好的除去NO物质,应控制的最佳温度在_____K左右。
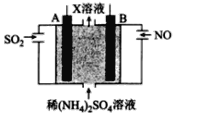
(4)利用电解原理也可以处理NO。下图为工业生产模拟装置。其中A、B为多孔电极(外接电源未画出),则B为___________极(填“正”“负”“阴”或“阳”,),A电极反应式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钾在氧气中燃烧时得到一种钾的氧化物晶体其结构如图所示,下列有关说法正确的是
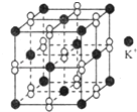
A.该氧化物属于离子晶体,其中只含离子键
B.1mol该晶体中含有的离子数目为3NA
C.晶体中与每个K+距离相等且最近的K+共有8个
D.晶体中每个K+同时吸引着6个阴离子
查看答案和解析>>
科目:高中化学 来源: 题型:
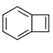
【题目】有机物![]() 是桥环烯烃类化合物,在药物合成、材料化学以及生命科学中有着重要的应用。下列关于该化合物的叙述正确的是( )
是桥环烯烃类化合物,在药物合成、材料化学以及生命科学中有着重要的应用。下列关于该化合物的叙述正确的是( )
A.分子式为C11H10
B.—氯代物有5种(不考虑立体异构)
C.不能形成高分子化合物
D.1mol该化合物最多能与3molH2发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】立方烷结构为立方体,分子式为C8H8,其熔点比相同碳原子的辛烷高,立方烷的结构简式如图所示。下列有关立方烷的说法正确的是( )
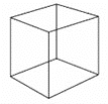
A.其一氯代物只有1种,二氯代物有2种
B.常温常压下为气体
C.与乙苯(结构简式为![]() )是同分异构体
)是同分异构体
D.与苯的含碳质量分数相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Z是一种常见的工业原料,实验室制备Z的化学方程式如下图所示。下列说法正确的是( )
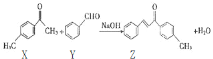
A.1molZ最多能与7molH2反应
B.Z分子中的所有原子一定共平面
C.可以用酸性KMnO4溶液鉴别X和Y
D.X的同分异构体中含有苯环和醛基的结构有14种(不考虑立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不同元素的原子在分子内吸引电子的能力大小可用一数值x来表示,若x越大,则原子吸引电子的能力越强,在所形成的分子中成为负电荷一方。下面是某些短周期元素的x值:

(1)通过分析x值的变化规律,确定N、Mg的x值范围: ____<x(N)<_____;_____<x(Mg)<_____。
(2)推测x值与原子半径的关系是_______________________________。
(3)某有机物结构式为C6H5SONH2,在S—N中,你认为共用电子对偏向谁?__________(写原子名称)。
(4)经验规律告诉我们当成键的两原子相应元素电负性的差值Δx>1.7时,一般为离子键,当Δx<1.7时,一般为共价键,试推断AlBr3中化学键的类型是____________。
(5)预测元素周期表中,x值最小的元素位置____________________(放射性元素除外)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素铬(Cr)在自然界主要以+3价和+6价存在。请回答下列问题:
(1)+6价的Cr能引起细胞的突变而对人体不利,可用 Na2SO3 将Cr2O72—还原为Cr3+。该反应的离子反应方程式为___________。
(2)利用铬铁矿(FeOCr2O3)冶炼制取金属铬的工艺流程如图所示:
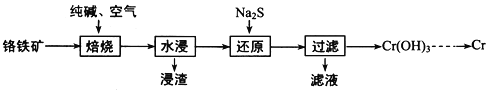
①为加快焙烧速率和提高原料的利用率,可采取的措施之一是__________________________ 。
②“水浸”要获得浸出液的操作是_________________________________。浸出液的主要成分为Na2CrO4,向“滤液”中加入酸化的氯化钡溶液有白色沉淀生成,则 “还原”操作中发生反应的离子方程式为___。
③加热Cr(OH)3可得到Cr2O3,从工业成本角度考虑,用Cr2O3制取金属Cr的冶炼方法是 _______。
(3)已知 Cr3+完全沉淀时溶液pH为5,(Cr3+浓度降至10-5molL-1可认为完全沉淀)则Cr(OH)3的溶度积常数 Ksp=_______________。
(4)用石墨电极电解铬酸钠(Na2CrO4)溶液,可制重铬酸钠(Na2Cr2O7),实验装置如图所示(已知:2Cr![]() +2H+
+2H+![]() Cr2
Cr2![]() + H2O)。
+ H2O)。
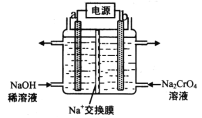
①电极b连接电源的______极(填“正”或“负”) , b 极发生的电极反应式为_________________。
②电解一段时间后,测得阳极区溶液中Na+物质的量由a mol变为b mol,则理论上生成重铬酸钠的物质的量是 _______________mol 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了验证凯库勒有关苯环结构的观点,甲同学设计了如下实验方案。
①按如图所示的装置图连接好各仪器;

②检验装置的气密性;
③在A中加入适量的苯和液溴的混合液体,再加入少量铁粉,塞上橡皮塞,打开止水夹K1、K2、K3;
④待C中烧瓶收集满气体后,将导管b的下端插入烧杯里的水中,挤压预先装有水的胶头滴管的胶头,观察实验现象。
请回答下列问题。
(1)A中所发生反应的反应类型为_________,能证明凯库勒观点错误的实验现象是_______。
(2)装置B的作用是__________。
(3)C中烧瓶的容积为500 mL,收集气体时,由于空气未排尽,最终水未充满烧瓶,假设烧瓶中混合气体对H2的相对密度为37.9,则实验结束时,进入烧瓶中的水的体积为________mL(空气的平均相对分子质量为29)。
(4)实验前应对A、B、C三个装置的气密性进行逐一检查,则检查装置C气密性的操作为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com