
【题目】砷元素广泛存在于自然界,砷与其化合物被运用在农药、除草剂、杀虫剂等。
(1)砷的常见氧化物有 As2O3 和 As2O5,其中 As2O5 热稳定性差。根据图 1 写出 As2O5 分解为 As2O3 的热化学方程式_________________。

(2)砷酸钠具有氧化性,298 K 时,在 100 mL 烧杯中加入 10 mL 0.1 mol/L Na3AsO4 溶液、20 mL 0.1 mol/L KI 溶液和 20 mL 0.05 mol/L硫酸溶液,发生下列反应:AsO43-(无色)+2I-+2H+ ![]() AsO33-(无色)+I2(浅黄色)+H2O ΔH。测得溶液中 c(I2)与时间(t)的关系如图 2 所示(溶液体积变化忽略不计)。
AsO33-(无色)+I2(浅黄色)+H2O ΔH。测得溶液中 c(I2)与时间(t)的关系如图 2 所示(溶液体积变化忽略不计)。
①下列情况表明上述可逆反应达到平衡状态的是_______(填字母代号)。
a.溶液颜色保持不再变化 b.c(AsO33-)+c(AsO43-)不再变化
c.AsO43-的生成速率等于 I2 的生成速率 d.![]() 保持不再变化
保持不再变化
②0~10 min 内,I的反应速率 v(I)=_______。
③在该条件下,上述反应的平衡常数 K=______。
④升高温度,溶液中 AsO43-的平衡转化率减小,则该反应的 ΔH______0(填“大于”“小于”或“等于”)。
(3)雄黄(As4S4)在空气中加热至 300℃时会生成两种氧化物,其中一种氧化物为剧毒的砒霜(As2O3), 另一种氧化物为______(填化学式),可用双氧水将 As2O3 氧化为 H3AsO4 而除去,写出该反应的化学方 程式_________。
【答案】As2O5(s)=As2O3(s)+O2(g ) △H=+295.4 kJ/mol ac 0.003 mol/(L·min) 4.5×106 L3/mol3 小于 SO2 2H2O2+H2O+As2O3=2H3AsO4
【解析】
(1)As2O5分解为As2O3需要吸收的热量为-619kJ/mol-(-914.6kJ/mol)=+295.4 kJmol-1,以此书写热化学方程式;
(2)①根据反应到达平衡状态时,正逆反应速率相等,平衡时各物质的浓度、百分含量不变分析判断;②根据v=![]() 计算;③计算平衡状态下的浓度,结合平衡常数K=
计算;③计算平衡状态下的浓度,结合平衡常数K=![]() 计算;④升高温度,AsO43-的平衡转化率减小,说明平衡逆向进行;
计算;④升高温度,AsO43-的平衡转化率减小,说明平衡逆向进行;
(3)雄黄在空气中加热至300℃时会 两种氧化物,其中一种氧化物为剧毒的砒霜(As2O3),依据原子守恒可知另一种氧化物为二氧化硫,过氧化氢中氢元素化合价-1价变化为-2价,As元素化合价+3价变化为+5价,结合电子守恒和原子守恒写出该反应的化学方程式。
(1)由图象可知,As2O5分解为As2O3需要吸收的热量为-619kJ/mol-(-914.6kJ/mol) =+295.4 kJmol-1,则热化学方程式As2O5(s)=As2O3(s)+O2(g) △H=+295.4 kJmol-1,故答案为:As2O5(s)=As2O3(s)+O2(g) △H=+295.4kJmol-1;
(2)①AsO43-(无色)+2I-+2H+ ![]() AsO33-(无色)+I2(浅黄色)+H2O。a.溶液颜色不再变化,说明碘的浓度不变,反应达到平衡状态,故a正确;b.根据原子守恒可知,c(AsO33-)+c(AsO43-)始终不变,不能说明反应达到平衡状态,故b错误;c.AsO43-的生成速率等于I2的生成速率,说明正逆反应速率相等,反应达到平衡状态,故c正确;d.根据方程式,AsO33-和I2的物质的量相同,
AsO33-(无色)+I2(浅黄色)+H2O。a.溶液颜色不再变化,说明碘的浓度不变,反应达到平衡状态,故a正确;b.根据原子守恒可知,c(AsO33-)+c(AsO43-)始终不变,不能说明反应达到平衡状态,故b错误;c.AsO43-的生成速率等于I2的生成速率,说明正逆反应速率相等,反应达到平衡状态,故c正确;d.根据方程式,AsO33-和I2的物质的量相同,![]() =1,始终保持不变,不能说明反应达到平衡状态,故d错误;故答案为:ac;
=1,始终保持不变,不能说明反应达到平衡状态,故d错误;故答案为:ac;
②图2可知,I2浓度变化为0.015mol/L,I-浓度变化0.03mol/L,0-10min,v(I-)=![]() =0.003mol/(Lmin),故答案为:0.003mol/(Lmin);
=0.003mol/(Lmin),故答案为:0.003mol/(Lmin);
③

K═![]() =4.5×106 L3/mol3,故答案为:4.5×106 L3/mol3;
=4.5×106 L3/mol3,故答案为:4.5×106 L3/mol3;
④升高温度,AsO43-的平衡转化率减小,说明平衡逆向进行,正反应为放热反应,△H小于0,故答案为:小于;
(3)雄黄在空气中加热至300℃时会 两种氧化物,其中的一种氧化物为剧毒的砒霜(As2O3),由原子守恒可知反应为As4S4+7O2 ![]() 2As2O3+4SO2,另一种氧化物为二氧化硫,双氧水将As2O3氧化为H3AsO4而除去,氧化还原反应中过氧化氢中氢元素化合价-1价变化为-2价,As元素化合价+3价变化为+5价,结合电子守恒和原子守恒写出该反应的化学方程式为2H2O2+H2O+As2O3=2H3AsO4,故答案为:SO2;2H2O2+As2O3+H2O=2H3AsO4。
2As2O3+4SO2,另一种氧化物为二氧化硫,双氧水将As2O3氧化为H3AsO4而除去,氧化还原反应中过氧化氢中氢元素化合价-1价变化为-2价,As元素化合价+3价变化为+5价,结合电子守恒和原子守恒写出该反应的化学方程式为2H2O2+H2O+As2O3=2H3AsO4,故答案为:SO2;2H2O2+As2O3+H2O=2H3AsO4。


 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:
【题目】化合物如图的分子式均为C7H8。下列说法正确的是
![]()
A. W、M、N均能与溴水发生加成反应B. W、M、N的一氯代物数目相等
C. W、M、N分子中的碳原子均共面D. W、M、N均能使酸性KMnO4溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯和丙烯是重要有机化工原料。
I.以乙烯为原料可以制备乙二醇和高分子化合物B。
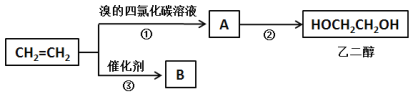
(1)①的化学方程式为______________。
(2)②为取代反应,通过A与NaOH溶液加热条件下完成转化。②的化学反应方程式为__________。
(3)③的反应类型为_______________,B的结构简式为________________。
II.丙烯酸乙酯天然存在于菠萝等水果中,是一种天然香料,也可以由乙烯和丙烯为原料合成。

(4)有机物E中的官能团是_________________。
(5) D与E反应生成丙烯酸乙酯的化学反应方程式为__________________。
(6)下列说法正确的是______________。
a.乙烯、丙烯是石油裂解的产物 b.乙二醇易溶于水
c.E能使酸性高锰酸钾溶液褪色 d.D可以由葡萄糖分解得到
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、X均为中学化学常见物质,一定条件下它们有如右图所示转化关系(其它产物已略去),下列说法错误的是( )

A. 若A为AlCl3,则X可能为KOH溶液 B. 若X为O2,A可能是C
C. 若A是强碱,则C可能是酸式盐 D. A也有可能是Mg
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铜是由铜和锌组成的合金,在黄铜中加入镍可显著提高黄铜在大气中和海水中的耐蚀性。回答下列问题:
(1)基态Ni2+的核外电子排布式为____________________,有_______个未成对电子。
(2)CuSO4溶液里逐滴滴入过量氨水,形成深蓝色溶液。
①深蓝色的溶液 是因为生成了一种配离子,其离子符号为____________________
其中配位原子是____________ 。
②NH3分子的空间构型是_______。NH3的键角______(填大于或小于)H2O,原因是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由N2O和NO反应生成N2和NO2的能量变化如图所示。下列说法不正确的是( )
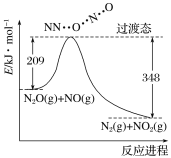
A.反应生成1 mol N2时转移4 mol e-
B.反应物能量之和大于生成物能量之和
C.N2O(g)+NO(g)=N2(g)+NO2(g) ΔH=-139 kJ·mol-1
D.断键吸收能量之和小于成键释放能量之和
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH=1的两种酸溶液A、B各1mL,分别加水稀释到1000mL,其pH与溶液体积(V)的关系如图所示,下列说法不正确的是( )

A.若a=4,则A是强酸,B是弱酸
B.稀释后,A酸溶液的酸性比B酸溶液弱
C.稀释前两种酸溶液的浓度:c(A)>c(B)
D.若1<a<4,则A、B都是弱酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向某NaOH溶液中通入CO2气体后得溶液M,因CO2通入量的不同溶液M的组成也不同.若向M中逐滴加入盐酸,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)的关系有下列图示四种情况(不计CO2的溶解),则下列对应图形的判断正确的是
A. 含有两种溶质 B. 只含有一种溶质
B. 只含有一种溶质 C. 只含有碳酸钠
C. 只含有碳酸钠 D. 有碳酸钠和碳酸氢钠
D. 有碳酸钠和碳酸氢钠
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com