
【题目】已知X(g)+3Y (g)![]() 2W(g) +M (g) △H=-a kJ·mol-1(a>0)。一定温度下,在体积恒定的密闭容器中,加入1 mol X(g) 与1mol Y (g),下列说法正确的是
2W(g) +M (g) △H=-a kJ·mol-1(a>0)。一定温度下,在体积恒定的密闭容器中,加入1 mol X(g) 与1mol Y (g),下列说法正确的是
A. 充分反应后,放出热量为a kJ
B. 当反应达到平衡状态时,X与W的物质的量浓度之比一定为1:2
C. 当X的物质的量分数不再改变,表明该反应已达平衡
D. 若增大Y的浓度,正反应速率增大,逆反应速率减小
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂,而且与Cl2相比不会产生对人体有潜在危害的有机氯代物。已知: ClO2浓度过高或受热易分解,甚至会爆炸。现有下列制备ClO2的方法:
(1)方法一:氧化法
可用亚氯酸钠和稀盐酸为原料制备,反应原理为5NaClO2+4HCl=5NaCl+4ClO2↑+2H2O。
①该反应中氧化剂和还原剂的物质的量之比是_______________________。
②研究表明:若反应开始时盐酸浓度较大,则气体产物中有Cl2,用离子方程式解释产生Cl2的原因__________。
(2)方法二:氯化钠电解法
①用于电解的食盐水需先除去其中的Ca2+、Mg2+、SO42-等杂质。某次除杂操作时,往粗盐水中先加入过量的____(填化学式),至沉淀不再产生后,再加入过量的Na2CO3和NaOH,充分反应后将沉淀一并滤去。
②该法工艺原理示意图如图所示。其过程是将食盐水在特定条件下电解得到的氯酸钠(NaClO3)与盐酸反应生成ClO2,氯化钠电解槽中发生反应的化学方程式为_____________。
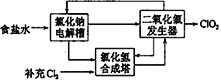
(3)方法三:草酸还原法
在酸性溶液中用草酸(H2C2O4)还原氯酸钠的方法来制备ClO2
①写出制备ClO2的离子方程式:____________________;
②与电解法相比,用草酸还原法制备ClO2的特点是____________________,提高了生产、储存及运输过程的安全性。
(4)已知: ClO2被I-还原为ClO2-、Cl-的转化率与溶液pH 的关系如图所示。当pH<2.0 时,ClO2-也能被I- 完全还原为Cl-。反应生成的I2与Na2S2O3 反应的方程式: 2Na2S2O3+ I2= Na2S4O6 + 2NaI。
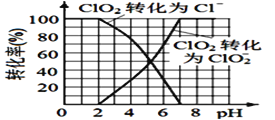
用ClO2消毒的饮用水中含有ClO2、ClO2-。测定饮用水中ClO2、ClO2-的含量,分两步进行:
①用紫外分光光度法测得水样中ClO2的含量为a mol/L。
②用滴定法测量ClO2-的含量。请完成相应的实验步骤:
步骤1: 准确量取V mL 上述水样加入锥形瓶中。
步骤2: 调节水样的pH________。
步骤3: 加入足量的KI 晶体,充分反应。
步骤4: 加入少量淀粉溶液,用c mol/L Na2S2O3 溶液滴定至终点,消耗Na2S2O3 溶液V1 mL。
根据上述分析数据,测得该饮用水中ClO2-的浓度为________mol/L( 用含字母的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A.Fe在O2中燃烧生成Fe3O4
B.常温下,Fe与浓硫酸不反应
C.Cu能与NaOH溶液反应放出H2
D.常温下,Cu能与稀盐酸反应放出H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是可逆反应:X2+3Y2![]() 2Z2在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是
2Z2在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是

A. t2~t3时,各物质的浓度不再发生变化 B. t2时,反应未达到限度
C. t2~t3时,反应已停止进行 D. t1时,反应只向正反应方向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 石油裂解气可以使溴水褪色,也可以使高锰酸钾溶液褪色
B. 可以用新制的氢氧化铜检验乙醇中是否含有乙醛
C. 正丙醇(CH3CH2CH2OH)和钠反应要比水和钠反应剧烈
D. CH2=CHCH3+Cl2 ![]() CH2=CHCH2 Cl+ HCl属于取代反应
CH2=CHCH2 Cl+ HCl属于取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车的启动电源常用蓄电池。其结构如下图所示,放电时其电池反应如下:PbO2+Pb+2H2SO4===2PbSO4+2H2O。根据此反应判断,下列叙述中不正确的是
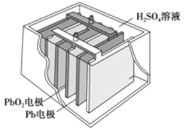
A. Pb作为负极,失去电子,被氧化
B. PbO2得电子,被还原
C. 负极反应是Pb+SO42--2e-===PbSO4
D. 电池放电时,溶液酸性增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)合成氨工艺(流程如图所示)是人工固氮最重要的途径。

2018年是合成氨工业先驱哈伯(PHaber)获得诺贝尔奖100周年。N2和H2生成NH3的反应为:1/2N2(g)+3/2H2(g) ![]() NH3(g) △H(298K)= - 46.2KJmol-1,在Fe催化剂作用下的反应历程为(*表示吸附态)
NH3(g) △H(298K)= - 46.2KJmol-1,在Fe催化剂作用下的反应历程为(*表示吸附态)
化学吸附:N2(g)→2N*;H2(g)→2H*;
表面反应:N*+ H*![]() NH*;NH*+ H*
NH*;NH*+ H*![]() NH2*;NH2* + H*
NH2*;NH2* + H*![]() NH3*
NH3*
脱附:NH3*![]() NH3(g)
NH3(g)
其中, N2的吸附分解反应活化能高、速率慢,决定了合成氨的整体反应速率。 请回答:
(1)利于提高合成氨平衡产率的条件有__________。
A.低温 B.高温 C.低压 D.高压 E.催化剂
(2)标准平衡常数KΘ=![]() ,其中pΘ为标准压强(1X105Pa),p NH3、 p N2和p H2为各组分的平衡分压,如p NH3=x NH3 p,p为平衡总压,x NH3为平衡系统中NH3的物质的量分数。
,其中pΘ为标准压强(1X105Pa),p NH3、 p N2和p H2为各组分的平衡分压,如p NH3=x NH3 p,p为平衡总压,x NH3为平衡系统中NH3的物质的量分数。
①N2和H2起始物质的量之比为1:3,反应在恒定温度和标准压强下进行,NH3的平衡产率为w,则KΘ=_____________(用含w的最简式表示)
②下图中可以示意标准平衡常数KΘ随温度T变化趋势的是_______。
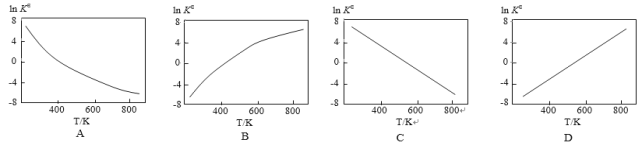 (3)实际生产中,常用工艺条件,Fe作催化剂,控制温度773K,压强3.0X105Pa,原料中N2和H2物质的量之比为1:2.8。
(3)实际生产中,常用工艺条件,Fe作催化剂,控制温度773K,压强3.0X105Pa,原料中N2和H2物质的量之比为1:2.8。
①分析说明原料气中N2过量的理由________________________。
②关于合成氨工艺的下列理解,正确的是_______。
A.合成氨反应在不同温度下的△H和△S都小于零
B.控制温度(773K)远高于室温,是为了保证尽可能的平衡转化率和快的反应速率
C.当温度、压强一定时,在原料气(N2和H2的比例不变)中添加少量惰性气体,有利于提高平衡转化率
D.基于NH3有较强的分子间作用力可将其液化,不断将液氨移去,利于反应正向进行
E.分离空气可得N2,通过天然气和水蒸气转化可得H2,原料气须经过净化处理,以防止催化剂中毒和安全事故发生。
(二)高铁酸钾(K2FeO4)可用作水处理剂。某同学通过“化学-电解法”探究的合成,其原理如图所示。接通电源,调节电压,将一定量Cl2通入KOH溶液,然后滴入含Fe3+的溶液,控制温度,可制得K2FeO4。
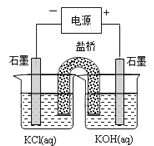
(1)请写出“化学法”得到FeO42-的离子方程式___________________________。
(2)请写出阳极的电极反应式(含FeO42-)___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,下列溶液的离子浓度关系式正确的是( )
A. 0.1molL-1NaHCO3溶液中:C(Na+)+C(H+)=C(HCO3-)+C(CO32-)+C(OH-)
B. Na2CO3溶液中:C(OH-)=C(H+)+C(HCO3-)+2C(H2CO3)
C. Na2S溶液中:2C(Na+)= C(S2-)+C(HS-)+C(H2S)
D. pH相同的①CH3COONa、②NaOH、③NaClO三种溶液的c(Na+):③>①>②
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com