
【题目】某研究性学习小组将下列装置如图连接,C、D、E、F、X、Y 都是惰性电极.将电源接通后,向乙中滴入酚酞试液,在F极附近显红色.试回答下列问题: 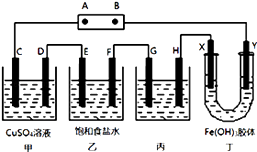
(1)电源A 极的名称是(正极或负极).
(2)甲装置中的C极的电极反应式 .
(3)欲用丙装置给铜镀银,G应该是(填“铜”或“银”),电镀液的主要成分是(填化学式).
(4)装置丁中的现象是 .
【答案】
(1)正极
(2)4OH﹣﹣4e﹣=O2↑+2H2O
(3)银;AgNO3
(4)Y极附近红褐色变深
【解析】解:将电源接通后,向乙中滴入酚酞试液,在F极附近显红色,说明F极生成OH﹣ , F为阴极,则可知A为正极,B为负极,C、E、G、X为阳极,D、F、H、Y为阴极,(1)由以上分析可知A是电源的正极,B是原电池的负极,所以答案是:正极;(2)电解硫酸铜溶液生成硫酸、铜和氧气,C是阳极,发生反应:4OH﹣﹣4e﹣=O2↑+2H2O,所以答案是:4OH﹣﹣4e﹣=O2↑+2H2O;(3)给铜镀银,金属银作阳极,纯铜作阴极,含有银离子的盐硝酸银溶液作电解质,所以答案是:银; AgNO3;(4)根据异性电荷相吸的原理,氢氧化铁胶体中含有的带正电荷的粒子会向阴极即Y极移动,所以Y极附近红褐色变深,所以答案是:Y极附近红褐色变深.


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:
【题目】某同学进行下列实验:( )
操作 | 现象 |
|
|
下列说法不合理的是
A.生铁片发生吸氧腐蚀
B.中心区:Fe–2e-=Fe2+
C.边缘处:O2+2H2O+4e-=4OH-
D.交界处:4Fe2++O2+10H2O=4Fe(OH)3+8H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关氨的性质的叙述中,正确的是
A.氨水是一种强碱B.氨气和酸都能在空气中相遇产生白色烟雾
C.液氨常用来做致冷剂D.氨的分子结构呈正四面体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是某兴趣小组通过实验获得的相同体积足量稀硫酸与铁反应的实验数据:
实验 | 金属 | 金属 | c(H2SO4) mol/L | 实验 | 金属消失 | |
1 | 0.10 | 丝 | 0.7 | 20 | 250 | |
2 | 0.10 | 丝 | 1.0 | 20 | 200 | |
3 | 0.10 | 粉末 | 1.0 | 20 | 125 | |
4 | 0.10 | 粉末 | 1.0 | 30 | 50 |
分析上述数据,回答下列问题:
(1)反应的离子方程式:;
(2)①实验1、2可得出的结论是,硫酸浓度越 , 反应速率越慢;
②实验2、3可得出的结论是反应物接触面越大,反应速率越;
③实验3、4可得出的结论是温度越 , 反应速率越快.
(3)①用铁粉和稀硫酸反应制取H2 , 实验过程中绘制出生成H2的体积(V)与时间(t)的关系如图所示. 试分析判断OE段、EF段、FG段、GH段反应速率(分别用v (OE)、v (EF)、v (FG)、v (GH)表示)最快时段是 .
A.v (OE) B.v (EF)
C.v (FG) D.v (GH)
②1min内反应较慢的原因是:;一段时间后反应明显加快的原因是 . 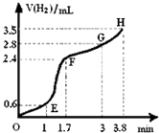
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知质量分数为25%的氨水密度是0.91g·cm-3,质量分数为5%的氨水密度是0.98 g·cm-3,若将上述两溶液等体积混合,所得氨水的质量分数是
A. 等于15% B. 小于15% C. 大于15% D. 无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有浓度均为0.1molL﹣1的盐酸、硫酸和醋酸三种溶液,试分析:
(1)若溶液的C(H+)分别为a、b、c,则它们的大小关系是(用“>”“<”“=”表示),
(2)分别用三种酸中和等物质的量的氢氧化钠溶液,所需溶液的体积分别是a、b、c,则它们的大小关系是(用“>”“<”“=”表示).
(3)等体积的三种酸分别与足量的锌粒反应,在相同条件下若产生气体的体积分别为a、b、c,则它们的关系是 .
(4)可逆反应2Cl2(g)+2H2O(g)4HCl(g)+O2(g)△H>0,在一定条件下达到平衡后,分别采取下列措施(填“增大”、“减小”或“不变”):
①降低温度,Cl2的转化率;
②保持容器体积不变,加入He,则HCl的物质的量;
③保持容器压强不变,加入He,则O2的体积分数 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浓盐酸瓶打开,瓶口往往会形成白色的酸雾,这是因为
①浓盐酸有挥发性,挥发出HCl气体;②天气较潮湿,空气中水气较多;③浓盐酸因溶有少量Fe3+,而显黄色;④HCl气体极易溶于水
A.①②③B.①②④C.①④D.①②
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com