
【题目】下列关于各装置图的叙述不正确的是
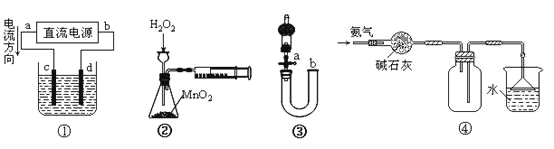
A.装置①中,c为阳极,d为阴极
B.装置②可定量测定H2O2的分解速率
C.关闭活塞a,从b处加水,可以检查装置③的气密性
D.装置④可用于收集并吸收多余的氨气
【答案】B
【解析】
A.装置①中, c电极与电源的正极连接,为阳极,d与电源的负极连接,为阴极,故A正确;
B.H2O2遇MnO2会分解产生O2,但是产生的氧气会从长颈漏斗中逸出,就不能准确测量氢气的体积,因此装置②不可定量测定H2O2的分解速率,故B错误;
C.关闭活塞a,从b处加水,若装置不漏气,则会在U型管的左右两端形成一段稳定的液差,故可以检查装置③的气密性,故C正确;
D.氨气是碱性气体,可以用碱石灰干燥,由于氨气的密度比空气小,所以用向下排空气的方法收集,由于氨气极容易溶于水,会引起倒吸现象的发生,为了防止倒吸的发生,在导气管的末端安装一个倒扣的漏斗,故装置④可用于收集并吸收多余的氨气,故D正确;
答案选B。


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:
【题目】N2O、NO和NO2等氮氧化物是空气污染物,含有氮氧化物的尾气需处理后才能排放。
(1)N2O的处理。N2O是硝酸生产中氨催化氧化的副产物,用特种催化剂能使N2O分解。NH3与O2在加热和催化剂作用下生成N2O的化学方程式为________。
(2)NO和NO2的处理。已除去N2O的硝酸尾气可用NaOH溶液吸收,主要反应为
NO+NO2+2OH![]() 2
2![]() +H2O
+H2O
2NO2+2OH![]()
![]() +
+![]() +H2O
+H2O
①下列措施能提高尾气中NO和NO2去除率的有________(填字母)。
A.加快通入尾气的速率
B.采用气、液逆流的方式吸收尾气
C.吸收尾气过程中定期补加适量NaOH溶液
②吸收后的溶液经浓缩、结晶、过滤,得到NaNO2晶体,该晶体中的主要杂质是________(填化学式);吸收后排放的尾气中含量较高的氮氧化物是________(填化学式)。
(3)NO的氧化吸收。用NaClO溶液吸收硝酸尾气,可提高尾气中NO的去除率。其他条件相同,NO转化为![]() 的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
①在酸性NaClO溶液中,HClO氧化NO生成Cl和![]() ,其离子方程式为________。
,其离子方程式为________。
②NaClO溶液的初始pH越小,NO转化率越高。其原因是________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁电池是电动汽车首选的电池之一,该电池的工作原理为:
3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH,
3Zn(OH)2+2Fe(OH)3+4KOH,
下列关于该电池放电时的说法中正确的是( )
A.高铁电池产生的电流从负极经外电路到达正极
B.正极反应式为Zn+2OH--2e- =Zn(OH)2
C.负极pH减小,正极pH增大,电解液pH增大
D.每氧化1mol高铁酸钾转移3mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示操作能实现实验目的的是( )
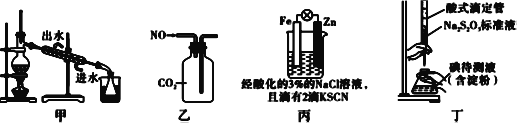
A. 用图甲装置分离碘和四氯化碳,在锥形瓶中收集到碘单质
B. 用图乙装置收集NO气体
C. 用图丙装置验证牺牲阳极的阴极保护法
D. 用图丁装置测定待测液中I2的含量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与人类生活密切相关,下列说法正确的是
A.“红柿摘下未熟,每篮用木瓜三枚故入,得气即发,并无涩味”,其中“气”是指乙酸乙酯
B.将碘酒滴到未成熟的苹果肉上变蓝说明苹果肉中含有淀粉
C.“丹砂烧之成水银,积变又还成丹砂”只涉及物理变化
D.食用黑芝麻糊时可加入白砂糖作配料,白砂糖的上要成分是麦芽糖
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物X是合成治疗癌症药物的中间体,其合成部分路径如下:
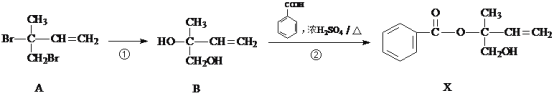
(1)反应①的反应物以及条件为________。
(2)由B制备X的过程中,有副产物C生成(与X互为同分异构体),C的结构简式为_____。
(3)下列有关X的说法正确的是________。
A.该物质属于芳香烃 B.X分子中含有一个手性碳原子
C.X可发生还原反应 D.用酸性高锰酸钾溶液可鉴别化合物X与B
(4)写出苯甲酸的一种含有苯环的同分异构体的结构简式_________。
(5)B在一定条件下发生加聚反应可得到一种高吸水性树脂,其结构简式为_________。
(6)写出X与NaOH溶液反应的化学方程式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于四种仪器装置的有关用法中不合理的是( )
A.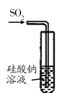 装置:可用来证明硫的非金属性比硅强
装置:可用来证明硫的非金属性比硅强
B.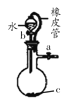 装置:橡皮管的作用是能使水顺利流下
装置:橡皮管的作用是能使水顺利流下
C.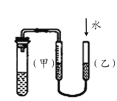 装置:用图示的方法能检查此装置的气密性
装置:用图示的方法能检查此装置的气密性
D. 装置:可在瓶中先装满水,气体由
装置:可在瓶中先装满水,气体由![]() 口入,收集NO气体
口入,收集NO气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,已知:NaClO2饱和溶液在温度低于38℃时析出晶体NaClO2![]() ,温度高于38℃时析出晶体NaClO2,温度高于60℃时NaClO2分解生成NaClO3和
,温度高于38℃时析出晶体NaClO2,温度高于60℃时NaClO2分解生成NaClO3和![]() 。其一种生产工艺如下。
。其一种生产工艺如下。

请回答下列问题:
(1)NaClO2中![]() 的化合价为_____________。
的化合价为_____________。
(2)反应I:
①![]() 做___________(填“氧化剂”或“还原剂”)。
做___________(填“氧化剂”或“还原剂”)。
②将反应I中的化学方程式补充完整:
![]() _____________
_____________
(3)电解II:
①所用食盐水由粗盐水精制而成,精制时,为除去粗盐水中的![]() 和
和![]() ,需要加入的试剂分别为_______、___________。
,需要加入的试剂分别为_______、___________。
②电解过程中被氧化的物质是________。
③可用![]() 溶液吸收电解产生的
溶液吸收电解产生的![]() ,该反应的离子方程式是______________。
,该反应的离子方程式是______________。
(4)操作III:
滤液获利NaClO2的操作步骤:①加热蒸发;②趁热过滤;③洗涤;④干燥,得到成品。趁热过滤应控制的温度范围是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用0.1mol/L的NaOH溶液,分别滴定20mL、浓度均为0.1mol/L的两种酸HX、HY。所加NaOH溶液体积与反应后溶液的pH的关系如图所示。下列叙述正确的是

A.0.1mol/L的一元酸HY在水中有1%发生电离
B.a点的导电能力比b点弱
C.b点溶液中,c(HY)+2c(H+)=c(Y-)+2c(OH-)
D.加NaOH溶液至pH=7时,两种溶液中,(X-)=c(Y-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com