
| A、碘易升华,所以要保存在铁盖旋紧的试剂瓶中 |
| B、液溴应保存在棕色磨口玻璃塞的试剂瓶中,并加少量水进行水封 |
| C、漂白粉可置露在空气中保存 |
| D、碘易溶于酒精,所以用酒精可以从碘水中萃取碘 |


科目:高中化学 来源: 题型:
| A、H+数目增加 |
| B、CH3COOH的电离程度变大 |
| C、溶液中c(OH-)增大 |
| D、溶液的导电能力减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、石油经蒸馏分离成为汽油、煤油和柴油等产品是利用了物质的沸点不同 |
| B、硝酸钾和氯化钾浓溶液降温结晶得到硝酸钾晶体是利用了它们的溶解度随温度变化不同 |
| C、使用酒精可以将溶解于水中的碘萃取出来 |
| D、沙里淘金是利用了物质的密度不同,从而达到提取黄金的目的 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、KCl |
| B、KCl和KBr |
| C、KCl和KI |
| D、KCl、Br2和I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
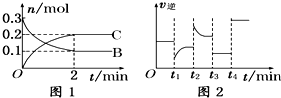 一定温度下,在2L的密闭容器中发生如下反应:A(s)+2B(g)?2C(g)△H<0,反应过程中B、C的物质的量随时间变化的关系如图1;反应达平衡后在t1、t2、t3、t4时分别都只改变了一种条件,逆反应速率随时间变化的关系如图2.下列有关说法正确的是( )
一定温度下,在2L的密闭容器中发生如下反应:A(s)+2B(g)?2C(g)△H<0,反应过程中B、C的物质的量随时间变化的关系如图1;反应达平衡后在t1、t2、t3、t4时分别都只改变了一种条件,逆反应速率随时间变化的关系如图2.下列有关说法正确的是( )| A、t1时改变的条件可能是升高温度 |
| B、t2时改变的条件可能是增大B的浓度 |
| C、t3时改变的条件可能是加压,此时c(B)不变 |
| D、t4时可能是使用了催化剂,此时c(B)不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1:1 | B、2:1 |
| C、5:1 | D、11:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 金属在人类文明的发展进程中发挥了巨大作用,在人们已知的100多种元素中,金属元素约占80%,以下是关于金属的一些问题,请回答:
金属在人类文明的发展进程中发挥了巨大作用,在人们已知的100多种元素中,金属元素约占80%,以下是关于金属的一些问题,请回答:| 金属 | K | Cu |
| 原子半径/pm | 255 | 128 |
| 熔点/℃ | mp1 | mp2 |
| 氟化物 | NaF | MgF2 | SiF4 |
| 熔点/℃ | 1266 | 1534 | 183 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com