
【题目】
A. 保存硫酸亚铁溶液时,向其中加入铁钉和少量硫酸
B. 少量金属锂保存在煤油中
C. 少量液溴可用水封存,防止溴挥发
D. 浓硝酸用带玻璃塞的细口、棕色试剂瓶盛放,并贮存在阴凉处
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案科目:高中化学 来源: 题型:
【题目】某工厂的工业废水中含有大量的FeSO4、较多的Cu2+和少量的Na+。为了减少污染并变废为宝,工厂计划从该废水中回收硫酸亚铁和金属铜。请根据流程图,回答下列问题:

(1)操作Ⅰ的名称为_________,所需要的玻璃仪器有_________、玻璃棒、烧杯;
(2)加入试剂C的目的是将Cu2+全部转化为Cu,以便回收铜单质,发生的离子方程式为__________________________________;
(3)操作Ⅲ为加热浓缩、__________、过滤、洗涤、干燥;
(4)由于硫酸亚铁溶液露置于空气中容易变质,请设计一个简单的实验方案验证硫酸亚铁是否变质?(请写出必要的实验步骤、现象和结论)____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 淀粉和纤维素在酸催化下完全水解后的产物都是葡萄糖
B. 乙醛和丙烯醛(![]() )不是同系物,它们与氢气充分反应后的产物也不是同系物
)不是同系物,它们与氢气充分反应后的产物也不是同系物
C. 乳酸薄荷醇酯(![]() )仅能发生水解、氧化、消去反应
)仅能发生水解、氧化、消去反应
D. 现代化学分析中,可采用质谱法来确定有机物分子中的官能团
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学是你,化学是我,化学深入我们生活。下列说法正确的是( )
A.木材纤维和土豆淀粉遇碘水均显蓝色
B.食用花生油和鸡蛋清都能发生水解反应
C.包装用材料聚乙烯和聚氯乙烯都属于烃
D.为了身体健康,不食用任何使用食品添加剂的食物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于基本营养物质的说法正确的是( )。
A.所有蛋白质均可通过颜色反应来鉴别
B.糖类、蛋白质、油脂都属于天然高分子化合物
C.糖类、油脂、蛋白质都是由C、H、O三种元素组成的
D.油脂在酸性条件下水解为丙三醇和高级脂肪酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图象能正确反映对应变化关系的是( )
A. 加热高锰酸钾固体制取氧气
B. 对于一定浓度的氢氧化钠溶液加水稀释
C. 对于某温度下的接近饱和的硝酸钾溶液,加入硝酸钾固体
D. 向一定浓度的稀硫酸中加入等质量的镁和铁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、现有下列4种有机物:①CH4 ②CH2=CH2 ③CH3CH2CH2CH3 ④CH3CH2OH
(1)与①互为同系物的是______(填序号)。
(2)写出④的官能团名称______。
(3)写出③的同分异构体的结构简式_______。
(4)写出②发生加聚反应生成聚乙烯的化学方程式_______。
II.实验室用下图所示的装置制取乙酸乙酯。

(1)在大试管中配制一定比例的乙醇、乙酸和浓硫酸的混合液,操作步骤如下:__________,然后轻振荡使其混合均匀。
(2)浓硫酸的作用是:① _______________;② ______________。
(3)右边装置中通蒸气的导管要插在液面上而不能插入溶液中,目的是防止溶液的倒吸。造成倒吸的原因是___________________。
(4)分离得到乙酸乙酯的方法是____________,分离需要的玻璃仪器是___________。
(5)若加的是C2H518OH写出制乙酸乙酯的方程式________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是优秀的水处理剂,具有很强的氧化性,氧化能力优于氯气和臭氧,溶于水中能有效杀灭水中的微生物和藻类,还能氧化分解各种有机、无机污染物,如酚、有机氮、硫化物、氰化物等,而且在整个净化过程中不会产生三氯甲烷、氯代酚等二次污染物。工业上常用次氯酸钠氧化法和电解法先制得高铁酸钠后再与氢氧化钾饱和溶液反应制备高铁酸钾。
I.电解法采用氢氧化钠作电解质溶液,铁丝网和石墨作电极材料,先制得高铁酸钠,请判断铁丝网作_______极, 阴极产生气体是__________。
II.次氯酸钠氧化法制备高铁酸钾简要流程如下:

(1)写出在碱性条件下过程①反应的离子方程式:___________________________________。
(2)过程②将混合溶液搅拌半小时,静置,抽滤获得粗产品。该反应的化学方程式为:2KOH+Na2FeO4=K2FeO4+2NaOH,请根据复分解反应原理分析反应发生的原因:______________________________________。
(3)K2FeO4溶于水后,会慢慢放出气体,并杀菌消毒,净化水中悬浮杂质,写出它和水反应的离子方程式_______________________________________________________。在提纯K2FeO4时采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用___________(填序号)。
A.H2O B.稀KOH溶液、异丙醇
C.KCl溶液、异丙醇 D.Fe(NO3)3溶液、异丙醇
(4)K2FeO4溶于水后,会水解生成如下图中的物种,纵坐标表示其分布分数,则下列说法不正确的是________________。
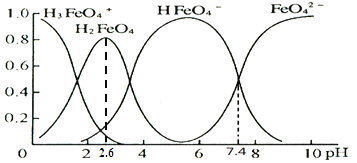
A.FeO42+H2OHFeO4+OH的平衡常数为107.4
B.从pH=1到pH=2.6,H2FeO4的分布分数逐渐增大
C.向pH=6的该溶液中加KOH溶液,反应的离子方程式为HFeO4+ OH = FeO42+H2O
D.根据图中信息,铁元素有4种存在形态,它们总是可以同时大量存在
(5)可用滴定分析法测定粗K2FeO4的纯度,有关反应离子方程式为:
①FeO42+CrO2 +2H2O=CrO42+Fe(OH)3↓+OH
②2CrO42+2H+=Cr2O72+H2O
③Cr2O72+6Fe2++14H+=2Cr3++6Fe3+ +7H2O
现称取1.980g粗高铁酸钾样品溶于适量氢氧化钾溶液中,加入稍过量的KCrO2,充分反应后过滤,滤液定容于250 mL容量瓶中。每次取25.00 mL加入稀硫酸酸化,用0.1000 mol/L的(NH4)2Fe(SO4)2标准溶液滴定,三次滴定消耗标准溶液的平均体积为21.90 mL。则上述样品中高铁酸钾的质量分数为______________。(保留四位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸(H2C2O4)是一种重要的有机化工原料.为探究草酸的性质,某化学研究性学习小组查阅了有关资料,有关物质的部分性质如下表:
物质 | 熔点/℃ | 性质 |
H2C2O4 | 189.5 | 有毒,具有腐蚀性,易溶于水,二元弱酸,比醋酸酸性强,100℃开始升华,157℃时开始分解.草酸与浓硫酸混合加热产生CO2,CO和H2O.草酸钙和草酸氢钙均为白色难溶物 |
[实验一]根据下图提供的仪器和试剂(可重复使用),设计实验证明草酸与浓硫酸混合加热产物中含有CO2和CO(部分夹持仪器和加热装置省略)。

(1)仪器接口依次连接的合理顺序为a→____________________________.
(2)用上图提供的仪器和试剂做实验时,首次使用的装置B中出现白色浑浊,并不能说明草酸受热分解产物中一定有CO2,请你提出改进意见:__________________.
(3)利用改进后的装置进行实验时,要先加热______装置(填装置标号,下同)后加热______装置.
[实验二]利用H2C2O4溶液和酸性KMnO4溶液反应来探究“条件对化学反应速率的影响”.
(4)实验时,先分别量取两种溶液,然后倒入试管中,迅速振荡混匀并开始计时,通过测定溶液褪色所需的时间来判断反应的快慢.该小组设计了如下的方案:
编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度/℃ | ||
浓度/ mol·L-1 | 体积/mL | 浓度/ mol·L-1 | 体积/mL | ||
1 | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
2 | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
3 | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
①已知反应后H2C2O4转化为CO2逸出,KMnO4转化为MnSO4,为了观察到紫色褪去,H2C2O4与KMnO4初始的物质的量需满足的关系为n(H2C2O4)/n(KMnO4) ≥__________.
②探究温度对化学反应速率影响的实验编号是__________,探究反应物浓度对化学反应速率影响的实验编号是__________.
③已知50℃时c(MnO![]() )-t(反应时间)的变化曲线如图.若保持其他条件不变,请在图中画出25℃时c(MnO
)-t(反应时间)的变化曲线如图.若保持其他条件不变,请在图中画出25℃时c(MnO![]() )-t的变化曲线示意图并注明温度.
)-t的变化曲线示意图并注明温度.

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com