
【题目】雌二醇和炔雌醇是两种雌激素用药,它们的结构简式如下,关于它们的说法不正确的是
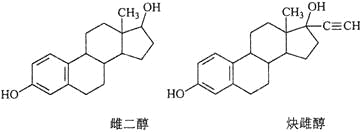
A. 核磁共振氢谱峰数相同
B. 均能发生加成反应、取代反应、消去反应
C. 两种分子中所有碳原子不可能在同一个平面内
D. 可用FeCl3溶液鉴别
【答案】D
【解析】
试题A,由雌二醇和炔雌醇的结构简式可以看出二者的结构虽然不同,但是它们的核磁共振氢谱峰数目相同。正确。B.雌二醇含有苯环,因此可以发生加成反应,含有醇羟基、甲基。可以发生取代反应;由于与羟基相连的C原子的邻位C原子上有H原子,所以还可以发生消去反应。炔雌醇含有苯环,可以发生加成反应,含有醇羟基、甲基。可以发生取代反应;由于与羟基相连的C原子的邻位C原子上有H原子,所以可以发生消去反应。正确。C.在这两种分子中都含有饱和C原子,由于饱和C原子构成的是四面体结构,因此原子不可能共平面。所以两种分子中所有碳原子不可能在同一个平面内。正确。D.二者都含有酚羟基,遇FeCl3都会发生显色反应,所以不可用FeCl3溶液鉴别。错误。


科目:高中化学 来源: 题型:
【题目】![]() 是大气污染物之一,实验室拟将
是大气污染物之一,实验室拟将![]() 与
与![]() 混合用
混合用![]() 溶液吸收的方法消除其污染。回答下列问题:
溶液吸收的方法消除其污染。回答下列问题:
(1)氯气的制备
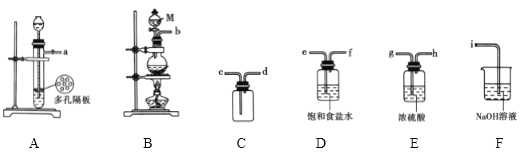
①仪器M的名称是_______________
②欲用![]() 和浓盐酸制备并收集一瓶纯净干燥的氯气,选择上图中的装置,其连接顺序为____________(按气流方向,用小写字母表示)。
和浓盐酸制备并收集一瓶纯净干燥的氯气,选择上图中的装置,其连接顺序为____________(按气流方向,用小写字母表示)。
③D在制备装置中的作用是______________;装置F的作用是__________________。
(2)用如下图所示装置,探究![]() 和
和![]() 在
在![]() 溶液中的反应。查阅有关资料可知:
溶液中的反应。查阅有关资料可知:![]() 是一种弱酸,且不稳定,易分解生成
是一种弱酸,且不稳定,易分解生成![]() 和
和![]() 。
。
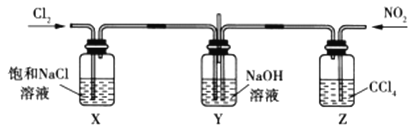
①装置中X和Z的作用是_______________
②实验时观察到X试剂瓶中有黄绿色气体,Z试剂瓶中有红棕色气体,若通入适当比例的![]() 和
和![]() ,Y中观察不到气体颜色,反应结束后加入稀硫酸无现象,则Y中发生反应的化学方程式是___________。
,Y中观察不到气体颜色,反应结束后加入稀硫酸无现象,则Y中发生反应的化学方程式是___________。
③反应结束后,取Y中溶液适量置于试管中,加入稀硫酸,若有红棕色气体产生,解释产生该现象的原因_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1molL-1NaOH溶液分别滴定20.00mL0.1molL-1的盐酸和苯甲酸溶液,滴定曲线如下图所示,下列说法正确的是

A.图Ⅰ、图Ⅱ分别是NaOH溶液滴定苯甲酸、盐酸的曲线
B.V(NaOH)=10.00mL时,滴定苯甲酸的混合溶液中c(C6H5COO-)> c(Na+)> c(H+)>c(OH-)
C.滴定苯甲酸溶液时最好选用甲基橙作指示剂
D.达到B、D状态时,NaOH溶液分别与盐酸、苯甲酸恰好发生中和反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常以闪锌矿(主要成分ZnS,含Fe、Cu、Cd等元素的杂质)为原料,通过火法或湿法炼锌,两种方法都是先将闪锌矿焙烧得到以ZnO为主要成分的焙砂,再分别制得锌。具体流程如下:
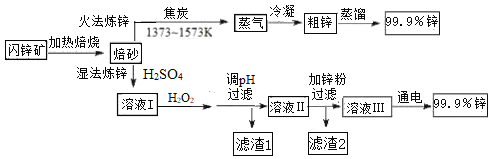
已知:
Fe3+ | Zn2+ | Cu2+ | Fe2+ | Cd2+ | |
开始沉淀的pH | 1.1 | 5.9 | 4.7 | 7.6 | 6.9 |
沉淀完全的pH | 3.2 | 8.1 | 6.7 | 9.6 | 9.7 |
(1)火法炼锌涉及的主要反应:
2C(s) + O2(g) = 2CO(g) H=﹣220 kJ· mol-1
2ZnS(s) + 3O2(g) = 2ZnO(s) + 2SO2(g) H=﹣930 kJ· mol-1
ZnO(s) + CO(g) = Zn(g) + CO2(g) H= +198 kJ· mol-1
则ZnS(s) + 2O2(g) + C(s) = Zn(g) +CO2(g) + SO2(g) 的H=_______________。
(2)湿法炼锌工艺中加入双氧水的目的是____________,调节pH的范围是________,滤渣1的成分是___________(写化学式),滤渣2的成分是___________(写化学式)。
(3)含锌废液是造成环境污染的重要原因之一。
①已知氢氧化锌和氢氧化铝性质相似。向电解后废液中加入稍过量的KOH溶液(假设其他物质不与碱反应),发生反应的离子方程式是_______________。
②一种生产锌的新技术碱浸—电解法的原理是:将ZnO溶于KOH溶液得到四羟基合锌酸钾[K2Zn(OH)4]溶液,再电解该溶液即获得金属锌。用石墨电极电解时阴极的反应式是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种高品质的磷矿石——鸟粪石的化学式为MgNH4PO4,下列关于该物质的结构和性质的推测中不合理的是( )
A.鸟粪石既属于镁盐又属于磷酸盐
B.鸟粪石既能和强酸反应又能和强碱反应
C.鸟粪石中既含有离子键又含有共价键
D.鸟粪石中两种阳离子的电子式分别为[··![]() ··]2+、[H··
··]2+、[H··![]() ··H]+
··H]+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃的结构简式如图,下列说法不正确的是
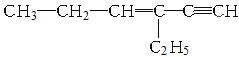
A.1mol该烃完全燃烧消耗O2 11molB.与氢气完全加成后的产物中含2个甲基
C.1mol该烃完全加成消耗Br2 3molD.分子中一定共平面的碳原子有6个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20.00mL0.1mol·L-1KOH溶液中滴加0.1 mol·L -1HA(弱酸)溶液,混合溶液中水电离出的c(OH-)与HA溶液体积之间的关系如图I所示:向20.00mL0.1 mol ·L-1 HA溶液中滴加0. 1mol ·L-1 KOH溶液,混合溶液中水电离出的c(OH-)与KOH溶液体积之间的关系如图II所示。

下列有关说法正确的是
A. A点、X点对应溶液中水的电离程度相同
B. B点、Y点对应溶液的pH相等
C. C点、Z点对应溶液中都存在:c(OH-)=c(H+)+c(HA)
D. D点、W点对应溶液中分别都存在:c(K+)=c(A-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】AG表示溶液酸度:![]() 。常温下,用0.1mol/L的NaOH溶液滴定25 ml 0.1mol/L的CH3COOH滴定结果如图所示,下列分析正确的是()
。常温下,用0.1mol/L的NaOH溶液滴定25 ml 0.1mol/L的CH3COOH滴定结果如图所示,下列分析正确的是()
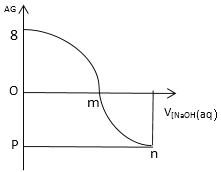
A.0.1mol/L的 CH3COOH溶液的pH=3
B.m点加入NaOH的体积为25mL
C.若pH=7,则溶液中水电离的c(OH-)=1.0×10-3.5 mol/L
D.随着NaOH溶液滴入,溶液中水的电离程度逐渐增大,m点最大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有下列6种离子中的某几种:Cl-、SO42-、CO32-、NH4+、Na+、K+。为确认溶液组成进行如下实验:(1) 200 mL上述溶液,加入足量BaCl2溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀4.30 g,向沉淀中加入过量的盐酸,有2.33 g沉淀不溶。(2) 向(1)的滤液中加入足量的NaOH溶液,加热,标准状况下产生能使湿润红色石蕊试纸变蓝的气体1.12 L。由此可以得出关于原溶液组成的正确结论是
A. 一定存在SO42-、CO32-、NH4+,可能存在Cl-、Na+、K+
B. 一定存在SO42-、CO32-、NH4+、Cl-,一定不存在Na+、K+
C. c(CO32-)=0.01mol·L-1,c(NH4+)>c(SO42-)
D. 如果上述6种离子都存在,则c(Cl-)>c(SO42-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com