
【题目】六种短周期元素a、b、c、d、e、f其原子序数与其最高正价或最低负价的关系如下图所示。

(1)上述六种元素,其中属于金属元素的有________种。
(2)元素f在周期表中的位置是____________。
(3)由a、b、c三种元素组成既含离子键又含共价键的化合物,该化合物的化学式为________,该化合物的水溶液显_________性,该化合物在水中的电离方程式为____________。
(4)b元素的气态氢化物与f元素的气态氢化物熔沸点高低顺序为_________(用氢化物的化学式表示)。
(5)a与b、c两元素分别可形成18电子的分子M和N,其中M的电子式为_______。化合物M是一种环保的液体燃料,常温下8g液态M与足量的液态N反应可放出204.5kJ的热量,则该反应的热化学反应方程式为___________________________。
【答案】 2 第3周期ⅤA族 NH4NO3 酸 NH4NO3 =NH4++NO3- NH3>PH3 ![]() N2H4(l)+2H2O2(l)= N2 (g)+4H2O(l) △H=-818kJ/mol
N2H4(l)+2H2O2(l)= N2 (g)+4H2O(l) △H=-818kJ/mol
【解析】试题分析:本题考查元素的推断,元素在周期表中的位置,盐的水解,电子式、电离方程式、热化学方程式的书写,物质熔沸点高低的比较。根据各元素的最高正价或最低负价与原子序数的关系可推出a、b、c、d、e、f依次为H、N、O、Na、Al、P元素。
(1)六种元素中属于金属元素的是Na、Al,有2种。
(2)f为P元素,P的原子序数为15,在周期表中位于第3周期VA族。
(3)H、N、O全是非金属元素,组成的含离子键的化合物为铵盐,由H、N、O三种元素组成的既含离子键又含共价键的化合物的化学式为NH4NO3。NH4NO3属于强酸弱碱盐,其水溶液由于NH4+的水解呈酸性。NH4NO3在水中的电离方程式为NH4NO3=NH4++NO3-。
(4)b的气态氢化物为NH3,f的气态氢化物为PH3,NH3、PH3都属于分子晶体,虽然相对分子质量:NH3![]() PH3,但由于NH3分子间形成氢键,PH3分子间没有氢键,熔沸点:NH3
PH3,但由于NH3分子间形成氢键,PH3分子间没有氢键,熔沸点:NH3![]() PH3。
PH3。
(5)a与b形成的18电子的分子M为N2H4,a与c形成的18电子的分子N为H2O2。M为N2H4,N2H4的电子式为![]() 。n(N2H4)=
。n(N2H4)=![]() =0.25mol,0.25molN2H4(l)与H2O2(l)反应放出204.5kJ的热量,1molN2H4(l)与H2O2(l)反应放出
=0.25mol,0.25molN2H4(l)与H2O2(l)反应放出204.5kJ的热量,1molN2H4(l)与H2O2(l)反应放出![]() =818kJ的热量,反应的热化学方程式为N2H4(l)+2H2O2(l)=N2 (g)+4H2O(l) △H=-818kJ/mol。
=818kJ的热量,反应的热化学方程式为N2H4(l)+2H2O2(l)=N2 (g)+4H2O(l) △H=-818kJ/mol。


科目:高中化学 来源: 题型:
【题目】某废催化剂含48.6% 的SiO2、16.2% 的ZnO、19.4% 的ZnS 和12 .8% 的CuS 及少量的Fe3O4。.某同学用10.0g该废催化剂为原料,回收锌和铜。采用的实验方案如下,回答下列问题:

已知:金属Zn 与Al类似,都是两性金属,能溶于强碱并放出氢气,但铝不溶于氨水,锌却可以溶于氨水形成四氨合锌配离子[Zn(NH3)4]2+。
(1)滤液1中含有Fe2+,选用提供的试剂进行检验,检验方法如下:__________________________。(提供的试剂:稀盐酸、KSCN 溶液、KMnO4 溶液、NaOH 溶液、K3[Fe(CN)6]溶液)
(2)滤渣2 除SiO2 外的另一成分是____________;第二次浸出时,加热温度不宜过高的原因是___________________;写出第二次浸出的化学反应方程式____________________________________。写出锌溶于氨水的离子方程式____________________________________。
(3)ZnSO4在水中的溶解度,随温度的升高而缓慢增大,从硫酸锌溶液得到七水硫酸锌晶体,可采用的方法是_____________________;析出七水硫酸锌晶体,减压过滤,用于淋洗七水硫酸锌晶体的溶剂是___________________;某同学在实验完成之后,得到5.74gZnSO4·7H2O(式量287)则锌的回收率为_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原是一类重要的反应。
(1)已知反应2I-+2Fe3+=I2+2Fe2+,反应中还原剂是_________,氧化性Fe3+______I2 (填“ < ”或“ > ”) 。
(2)在2Na2O2+2CO2=2Na2CO3+O2反应中,若转移3mol电子,则所产生的氧气在标准状况下的体积为___________L。
(3)在xR2++yH++O2═mR3++nH2O的离子方程式中,对系数m和R2+、R3+判断正确的是__。
A.m=y,R3+是还原剂 B.m=2y,R2+被氧化
C.m=2,R3+是氧化剂 D.m=4,R2+是还原剂
(4)用双线桥标出反应2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O中电子转移的方向和数目_________。
(5)氯气和石英砂、碳粉共热可发生反应:SiO2+2C+2Cl2![]() SiCl4+2CO当反应消耗6g碳时,生成还原产物_________mol。
SiCl4+2CO当反应消耗6g碳时,生成还原产物_________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气和燃煤造成空气污染. 
(1)CO2是大气中含量最高的一种温室气体,控制和治理CO2是解决温室效应的有效途径.目前,由CO2来合成二甲醚已取得了较大的进展,其化学反应是:2CO2(g)+6H2(g)CH3OCH3(g)+3H2O(g)△H=+QkJ/mol
①反应的平衡常数和温度的关系如表:
温度/℃ | 700 | 800 | 830 | 1000 | 1200 |
平衡常数 | 0.4 | 0.6 | 1.0 | 1.1 | 1.7 |
写出该反应平衡常数表达式:K= .
向一个10L的密闭容器中充入10mol CO2和7molH2 , 830℃时测得H2为lmol,此时V (正)V (逆):(选填“>”、“<”)
②判断该反应在一定温度下,体积恒定的密闭容器中达到化学平衡状态的依据是 .
A.容器中密度不变
B.容器内压强保持不变
C.平均摩尔质量保持不变
D.v(CO2):v(H2)=1:3
E.单位时间内消耗2mol CO2 , 同时消耗1mol二甲醚
F.△H不变
(2)汽车尾气净化的主要原理为2NO(g)+2CO(g)2CO2(g)+N2(g).在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图1所示.
①在T2温度下,0~2s内的平均反应速率v(N2)=;
②当固体催化剂的质量一定时,增大其表面积可提高化学反应速率.若催化剂的表面积S1>S2 , 在上图中画出c(CO2)在T1、S2条件下达到平衡过程中的变化趋势曲线.
(3)工业上用CO和H2合成 CH3OH:CO (g)+2H2(g)CH3OH (g)
①现在容积均为1L的a、b、c三个密闭容器中分别充入1mol CO和2mol H2的混合气体,控制温度进行反应,测得相关数据的关系如图2所示.下列说法正确的是
a.正反应的△H>0
b.反应进行到5min时,b容器中v正=v逆
c.减压可使甲醇的含量由b点变成c点
d.达到平衡时,a、b、c中CO的转化率为b>a>c
②某温度下,在体积固定的4L密闭容器中将1molCO和2molH2混合,测得不同时刻的反应前后压强关系如表:
时间(min) | 5 | 10 | 15 | 20 | 25 | 30 |
压强比(p后/p前) | 0.98 | 0.90 | 0.80 | 0.70 | 0.70 | 0.70 |
达到平衡时CO的转化率为
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如图所示.已知:pM=﹣lg c(M),pCO32﹣=﹣lg c(CO32﹣).下列说法不正确的是( ) 
A.MgCO3、CaCO3、MnCO3 的Ksp依次减小
B.a 点可表示MnCO3 的饱和溶液,且c(Mn2+)=c(CO32﹣)
C.b 点可表示的CaCO3不饱和溶液,且c(Ca2+)<c(CO32﹣)
D.c 点可表示MgCO3 的不饱和溶液,且c(Mg2+)<c(CO32﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组利用硝酸和废铜屑(含Cu和CuO)作为原料制备硝酸铜,设计的流程如下:
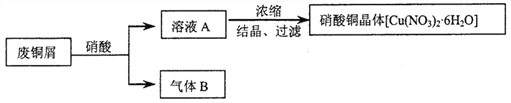
(1)某次实验使用了废铜屑共24g,用一定浓度的硝酸100mL完全溶解这些废铜屑时,共收集到标准状况下B气体6.72L(其中NO2和NO的体积比为2∶1)。请通过计算回答下列问题:
①废铜屑中铜和氧化铜的物质的量之比_____________。
②若测得溶液A中H+的浓度为1mol·L-1,则原硝酸的物质的量浓度为________________。(假设反应前后溶液的体积不变)
(2)上述制备方案中产生的气体B,既造成原料的浪费,也污染了环境。请你设计方案解决上述问题___________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲提纯混有硫酸钠、碳酸氢铵的氯化钠固体,某学生设计了如下方案:

请根据操作流程回答下列问题:
(1)操作①在加热时应选择_________盛装混合物(填仪器名称)。
(2)进行操作②后,判断SO42-已沉淀完全的方法是_________。
(3)操作③的离子方程式为_________。
(4)操作④的目的是_________。
(5)实验室进行操作⑤的具体步骤是_________。
(6)某同学欲用制得的氯化钠固体配制100mL0.2mol·L-1的氯化钠溶液。
①配制NaCl溶液时需用到的主要仪器有托盘天平、药匙、烧杯、玻璃棒、量筒、_________。
②下列操作会使所配氯化钠溶液浓度偏小的是_________(请填序号)。
A.加水定容时俯视刻度线
B.容量瓶内壁附有水珠而未干燥处理
C.在溶解过程中有少量液体溅出烧杯外
D.颠倒摇匀后发现凹液面低于刻度线又加水补上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应Fe(s)+CO2(g)FeO(s)+CO(g),700℃时平衡常数为1.47,900℃时平衡常数为2.15.下列说法正确的是( )
A.升高温度该反应的正反应速率增大,逆反应速率减小
B.该反应的化学平衡常数表达式为K= ![]()
C.该反应的正反应是吸热反应
D.增大CO2浓度,平衡常数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表所列各组第Ⅰ栏中的化学反应与第Ⅱ栏中的化学反应,都可以用第Ⅲ栏中的离子方程式表示的是( )
选项 | 第Ⅰ栏 | 第Ⅱ栏 | 第Ⅲ栏 |
A | 向AlCl3溶液中加入少量的NaOH溶液 | 向AlCl3溶液中加入过量的NaOH溶液 | Al3++4OH-===AlO |
B | 往Fe2(SO4)3溶液中滴入氢氧化钠溶液 | 往Fe2(SO4)3溶液中滴入氢氧化钡溶液 | Fe3++3OH-===Fe(OH) 3↓ |
C | 往NaHCO3溶液中滴入少量 Ca(OH)2溶液 | 往Ca(HCO3)2溶液中加入过量NaOH溶液 | Ca2++2OH-+2HCO ===CaCO3↓+CO |
D | 往Na2SiO3溶液中通入过量CO2气体 | 往Na2SiO3溶液中通入少量CO2气体 | SiO32-+CO2+H2O=CO32-+H2SiO3↓ |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com