
【题目】某研究性学习小组利用硝酸和废铜屑(含Cu和CuO)作为原料制备硝酸铜,设计的流程如下:
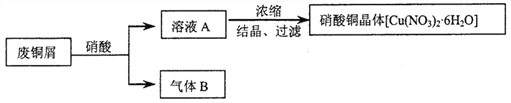
(1)某次实验使用了废铜屑共24g,用一定浓度的硝酸100mL完全溶解这些废铜屑时,共收集到标准状况下B气体6.72L(其中NO2和NO的体积比为2∶1)。请通过计算回答下列问题:
①废铜屑中铜和氧化铜的物质的量之比_____________。
②若测得溶液A中H+的浓度为1mol·L-1,则原硝酸的物质的量浓度为________________。(假设反应前后溶液的体积不变)
(2)上述制备方案中产生的气体B,既造成原料的浪费,也污染了环境。请你设计方案解决上述问题___________________________________________________________________________。
【答案】 5∶2 11mol·L-1 将生成的气体B和空气混合,再用水吸收重新利用(或将铜屑在空气中充分加热氧化,再用硝酸溶解)
【解析】(1)①废铜屑中铜和氧化铜的物质的量分别是xmol、ymol,则64x+80y=24;混合气体的物质的量是6.72L÷22.4L/mol=0.3mol,其中NO2和NO的体积比为2∶1,则NO2和NO的物质的量分别是0.2mol、0.1mol,根据电子得失守恒可知2x=0.2×1+0.1×3,解得x=0.25,所以y=0.1,因此废铜屑中铜和氧化铜的物质的量之比5∶2。②若测得溶液A中H+的浓度为1mol·L-1,即剩余硝酸的物质的量是0.1mol,生成硝酸铜是0.35mol,所以根据氮原子守恒可知原硝酸的物质的量浓度为(0.1+0.35×2+0.3)mol÷0.1L=11mol·L-1;(2)要防止原料的浪费,避免污染环境可以将生成的气体B和空气混合,再用水吸收重新利用或将铜屑在空气中充分加热氧化,再用硝酸溶解。


 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值,下列叙述正确的是
A. 0.5mol熔融的NaHSO4中含有的离子数目为NA
B. 12g金刚石中含有C-C键数目为4NA
C. 25℃时,Ksp(BaSO4)=1×10-10,则饱和BaSO4溶液中Ba2+数目为1×10-5NA
D. 1mol的Na2O和BaO2混合物中含有的阴、阳离子总数为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各表述与示意图一致的是( ) 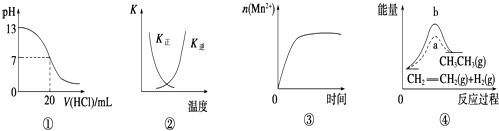
A.图①表示25℃时,用0.1 mol/L盐酸滴定20 mL 0.1 mol/L NaOH溶液,溶液的pH随加入酸体积的变化
B.图②中曲线表示反应2SO2(g)+O2(g)2SO3(g)△H<0正、逆反应的平衡常数K随温度的变化
C.图③表示10 mL 0.01 mol/L KMnO4酸性溶液与过量的0.1 mol/L H2C2O4溶液混合时,n(Mn2+)随时间的变化
D.图④中a、b曲线分别表示反应:CH2═CH2(g)+H2(g)→CH3CH3(g)△H<0使用和未使用催化剂时,反应过程中的总能量变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将1.000molL﹣1盐酸滴入20.00mL 1.000molL﹣1氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示.下列有关说法正确的是( ) 
A.a点由水电离出的c(H+)=1.0×10﹣14molL﹣1
B.b点:c(NH4+)+c(NH3H2O)=c(Cl﹣)
C.c点:c(Cl﹣)=c(NH4+)
D.d点后,溶液温度略下降的主要原因是NH3H2O电离吸热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】六种短周期元素a、b、c、d、e、f其原子序数与其最高正价或最低负价的关系如下图所示。

(1)上述六种元素,其中属于金属元素的有________种。
(2)元素f在周期表中的位置是____________。
(3)由a、b、c三种元素组成既含离子键又含共价键的化合物,该化合物的化学式为________,该化合物的水溶液显_________性,该化合物在水中的电离方程式为____________。
(4)b元素的气态氢化物与f元素的气态氢化物熔沸点高低顺序为_________(用氢化物的化学式表示)。
(5)a与b、c两元素分别可形成18电子的分子M和N,其中M的电子式为_______。化合物M是一种环保的液体燃料,常温下8g液态M与足量的液态N反应可放出204.5kJ的热量,则该反应的热化学反应方程式为___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属镍具有优良的物理和化学特性,是高技术产业的重要原料.
羰基法提纯镍涉及的反应为:Ni(s)+4CO(g)Ni(CO)4(g)
①当温度升高时, ![]() 减小,则△H0(填“>”或“<”).
减小,则△H0(填“>”或“<”).
②一定温度下,将一定量的粗镍和CO加入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是(填代号)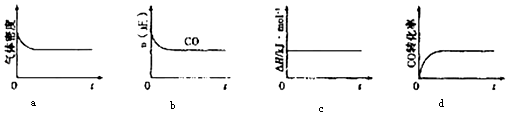
在相同温度下,上述反应改在体积为1L的恒容密闭容器中进行,平衡常数(填“增大”、“不变”或“减小”),反应进行3s后测得Ni(CO)4的物质的量为0.6mol,则0﹣3s内的平均反应速率v(CO)= .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式表达正确的是(![]() 的绝对值均正确)
的绝对值均正确)
A. C2H5OH(1)+3O2(g)=2CO2(g)+3H2O(g) △H=–1367.0 kJ/mol(燃烧热)
B. NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(1) △H= +57.3kJ/mol(中和热)
C. S(s)+O2(g)=SO2(g) △H=–269.8kJ/mol (反应热)
D. 2NO2=O2+2NO △H= +116.2kJ/mol (反应热)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有Al、C12、Al2O3、HCl(aq)、Al(OH)3、NaOH(aq)六种物质,它们之间有如图所示转化关系,图中每条线两端的物质之间都可以发生反应,下列推断不合理的是( )
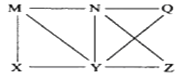
A. N一定是HCl(aq) B. X可能为Al或C12
C. Y一定为NaOH(aq) D. Q、Z中的一种必定为Al2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为检验某卤代烃(R﹣X)中的X元素,有下列实验操作:①加热煮沸;②加入AgNO3溶液;③取少量卤代烃;④加入稀硝酸酸化;⑤加入NaOH溶液;⑥冷却.正确操作的先后顺序是( )
A.③①⑤⑥②④
B.③①②⑥④⑤
C.③⑤①⑥④②
D.③⑤①⑥②④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com