
【题目】现定义pOH=![]() lg[OH],如图说法正确的是
lg[OH],如图说法正确的是
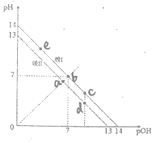
A.图中线II的温度低于室温
B.图中五点Kw间的关系是:e>b>c>a>d
C.c、d、e处的水溶液中的水的电离平衡一定被抑制
D.a点时,将pH=2的硫酸溶液与pH=12的KOH溶液等体积混合后,溶液显碱性
【答案】D
【解析】
根据pOH=![]() lg[OH],由图像可知,线II对应的
lg[OH],由图像可知,线II对应的![]() ,线I对应的
,线I对应的![]() 。
。
A. 线II对应的![]() ,线I对应的
,线I对应的![]() ,升高温度,水的离子积常数增大,图中线II的温度高于室温,故A错误;
,升高温度,水的离子积常数增大,图中线II的温度高于室温,故A错误;
B. 水的离子积常数只与温度有关,由图像可知,线II的![]() ,线I对应的
,线I对应的![]() ,图中五点Kw间的关系是:a=d> e=b=c,故B错误;
,图中五点Kw间的关系是:a=d> e=b=c,故B错误;
C. c、d处溶液显酸性,可能是酸溶液或盐溶液;e处的水溶液呈碱性,可能是碱溶液或盐溶液; c、d、e处的水溶液中的水的电离平衡可能被抑制,也可能被促进,故C错误;
D. a点时![]() ,pH=12的KOH溶液中c(OH-)=0.1mol/L,pH=2的硫酸溶液中c(H+)=0.01mol/L,将pH=2的硫酸溶液与pH=12的KOH溶液等体积混合后,KOH有剩余,溶液显碱性,故D正确。
,pH=12的KOH溶液中c(OH-)=0.1mol/L,pH=2的硫酸溶液中c(H+)=0.01mol/L,将pH=2的硫酸溶液与pH=12的KOH溶液等体积混合后,KOH有剩余,溶液显碱性,故D正确。


科目:高中化学 来源: 题型:
【题目】按如图所示装置进行实验,将液体A逐滴加入到固体B中,下列叙述不正确的是
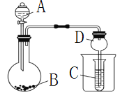
A. 若A为浓硫酸,B为K2SO3,C中盛品红溶液,则C中溶液褪色
B. 若A为浓氨水,B为生石灰,C中盛AlCl3溶液,则C中先变浑浊后澄清
C. 若A为醋酸,B为CaCO3,C中盛Na2SiO3溶液,则C中溶液中变浑浊
D. 若A为双氧水,B为MnO2,C中盛Na2S溶液,则C中溶液中变浑浊
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以废旧锌锰电池初步处理分选出的含锰废料(MnO2、MnOOH、MnO及少量Fe、Pb等)为原料制备高纯MnCl2·xH2O,实现锰的再生利用。其工作流程如下:
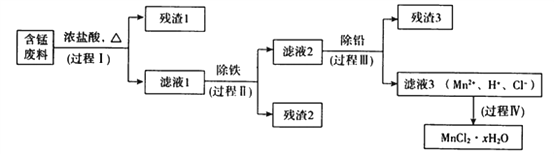
资料a.Mn的金属活动性强于Fe;Mn2+在酸性条件下比较稳定,pH高于5.5时易被O2氧化。
资料b.生成氢氧化物沉淀的pH
Mn(OH)2 | Pb(OH)2 | Fe(OH)3 | |
开始沉淀时 | 8.1 | 6.5 | 1.9 |
完全沉淀时 | 10.1 | 8.5 | 3.2 |
注:金属离子的起始浓度为0.1 mol·L-1
(1)过程Ⅰ的目的是浸出锰。经检验滤液1中含有的阳离子为Mn2+、Fe3+、Pb2+和H+。
①MnOOH与浓盐酸反应的离子方程式是_______________________________。
②检验滤液1中只含Fe3+不含Fe2+的操作和现象是:_________________________________________。
③Fe3+由Fe2+转化而成,可能发生的反应有:
a.2Fe2++Cl2=2Fe3+2Cl-
b.4Fe2++O2+4H+=2Fe3++2H2O
c.……
写出c的离子方程式:____________________。
(2)过程Ⅱ的目的是除铁。有如下两种方法,
ⅰ.氨水法:将滤液1先稀释,再加适量10%的氨水,过滤。
ⅱ.焙烧法:将滤液1浓缩得到的固体于290℃焙烧,冷却,取焙烧物,加水溶解,过滤,再加盐酸酸化至pH小于5.5。
已知:焙烧中发生的主要反应为2FeCl3+3O2=2Fe2O3+3Cl2,MnCl2和PbCl2不发生变化。
①氨水法除铁时,溶液pH应控制在_____________之间。
②两种方法比较,氨水法除铁的缺点是____________。
(3)过程Ⅲ的目的是除铅。加入的试剂是____________。
(4)过程Ⅳ所得固体中的x的测定如下,取m1g样品,置于氯化氢氛围中加热至失去全部结晶水时,质量变为m2g。则x=____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,2H2(g)+O2(g)![]() 2H2O(l)+566kJ。下列说法错误的是
2H2O(l)+566kJ。下列说法错误的是
A.H2![]() H+H的过程需要吸热
H+H的过程需要吸热
B.若生成2mol水蒸气,则放出的热量大于566kJ
C.2g氢气完全燃烧生成液态水所释放的能量为283kJ
D.2mol氢气与1mol氧气的能量之和大于2mol液态水的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】300mLAl2(SO4)3溶液中,含有Al3+为1.62 克,在该溶液中加入0.1mol/LBa(OH)2溶夜300ml,反应后溶液中SO42-的物质的量浓度约为
A. 0.4 mol/L B. 0.3 mol/L C. 0.1 mol/L D. 0.2mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计如图装置,研究非金属元素性质变化规律。
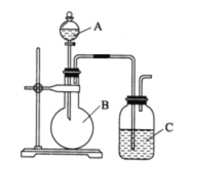
已知:高锰酸钾在常温下与浓盐酸反应产生氯气,离子方程式为______。
(1)如果C中装饱和的H2S溶液,A中装浓盐酸,B中装高锰酸钾溶液,反应开始后观察到现象是C中产生淡黄色沉淀,证明氯的非金属性比硫的非金属性________(填“强”或“弱”或“无法判断”;请用电子式表示H2S的形成过程:_____。
(2)利用如图装置证明Cl2氧化性强于I2的氧化性。则A中装浓盐酸,B中装入高锰酸钾粉末, C中装入淀粉KI溶液,则C中现象是______。
(3)现有浓硝酸、大理石、澄清石灰水、硅酸钠溶液,选择试剂用如图装置证明:非金属性:N > C > Si。C中装试剂______,实验现象为_________该装置存在不足之处,改进措施为:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年9月12日11时26分,我国在太原卫星发射中心用长征四号乙运载火箭,成功将资源一号02D卫星发射升空。资源一号02D卫星将为国家自然资源资产管理和生态监理工作提供稳定的数据保障,同时兼顾防灾减灾、环境保护、城乡建设、交通运输、应急管理等相关领域应用需求。
(1)卫星改变运行的路线时需要喷火消耗燃料,其燃料一般是肼(N2H4)。肼中N的化合价是___,肼在空气中燃烧的化学方程式如下,请用双线桥法标出该反应中电子转移的方向和数目___。
N2H4+O2![]() N2+2H2O
N2+2H2O
该反应中的氧化剂是___,被氧化的元素是___,每生成1molH2O转移电子___mol。
(2)近几年来,太原市在环境保护方面采取了一系列措施,其中的喷雾车、洒水车都是为了降低空气中的粉尘。含有粉尘的空气是否属于胶体___(填“是”或“否”),证明的方法是___,观察到的现象是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】加碘食盐是含KIO3的食盐,其中KIO3可由反应KI+3Cl2+3H2O=KIO3+6HCl制取。市面上销售的加碘食盐中的碘元素含量为20~50mg/kg。请计算:制取1000kg含碘元素25.4mg/kg的加碘食盐,需要消耗Cl2的体积是多少___?(标准状况)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含有11.2 g KOH的稀溶液与1 L 0.1 molL﹣1的H2SO4溶液反应,放出11.46 kJ的热量,下列热化学方程式正确的是
A. KOH(aq)+![]() H2SO4(aq) ===
H2SO4(aq) === ![]() K2SO4(aq)+H2O(l) ΔH =-11.46 kJmol﹣1
K2SO4(aq)+H2O(l) ΔH =-11.46 kJmol﹣1
B. 2KOH(aq)+H2SO4(aq) === K2SO4(aq)+2H2O(l) ΔH =-11.46 kJmol﹣1
C. 2KOH(aq)+H2SO4(aq) === K2SO4(aq)+2H2O(l) ΔH =+114.6 kJmol﹣1
D. KOH(aq)+![]() H2SO4(aq) ===
H2SO4(aq) === ![]() K2SO4(aq)+H2O(l) ΔH =-57.3 kJmol﹣1
K2SO4(aq)+H2O(l) ΔH =-57.3 kJmol﹣1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com