
【题目】加碘食盐是含KIO3的食盐,其中KIO3可由反应KI+3Cl2+3H2O=KIO3+6HCl制取。市面上销售的加碘食盐中的碘元素含量为20~50mg/kg。请计算:制取1000kg含碘元素25.4mg/kg的加碘食盐,需要消耗Cl2的体积是多少___?(标准状况)
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某校化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下实验,如图Ⅰ-Ⅳ所示。
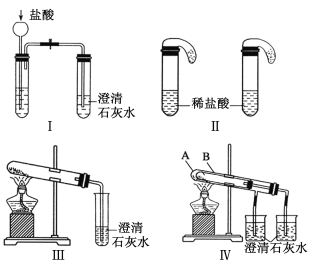
(1)只根据图Ⅰ、Ⅱ所示实验,能够达到实验目的的是(填装置序号)___________;
(2)图Ⅲ、Ⅳ所示实验均能鉴别这两种物质,其反应的化学方程式为___________;
与实验Ⅲ相比,实验Ⅳ的优点是(填选项序号)_____;
A.Ⅳ比Ⅲ复杂 B.Ⅳ比Ⅲ安全
C.Ⅳ比Ⅲ操作简便 D.Ⅳ可以做到一套装置同时进行两个对比实验,而Ⅲ不能
(3)若用实验装置Ⅳ验证碳酸钠和碳酸氢钠的稳定性,则试管B中装入的固体最好是______;
(4)将碳酸氢钠溶液与澄清石灰水混合并充分反应,
①当石灰水过量时,其离子方程式是_____________;
②当碳酸氢钠与氢氧化钙物质的量之比为2:1时,所得溶液中溶质的化学式为______,请设计实验检验所得溶液中溶质的阴离子__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现定义pOH=![]() lg[OH],如图说法正确的是
lg[OH],如图说法正确的是
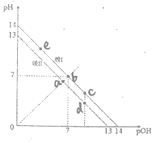
A.图中线II的温度低于室温
B.图中五点Kw间的关系是:e>b>c>a>d
C.c、d、e处的水溶液中的水的电离平衡一定被抑制
D.a点时,将pH=2的硫酸溶液与pH=12的KOH溶液等体积混合后,溶液显碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列所示的图像能反映相对应实验的是

A.向pH=13的NaOH溶液中不断加水稀释
B.向碳酸氢钠溶液中逐滴加入稀盐酸至过量
C.将60℃接近饱和的硝酸钾溶液恒温蒸发水分至有白色晶体析出
D.将足量的金属镁片和锌片分别和等质量、相同质量分数的稀硫酸混合
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(9分)某化学兴趣小组对生石灰与水反应是显著放热反应进行了实验探究,在除了用手触摸试管壁感觉发热外,还设计了下列几个可行性方案。
甲方案:将温度计与盛放有生石灰的小试管用橡皮筋捆绑在一起,放入有水的小烧杯中,用胶头滴管向小试管中缓缓滴入水,看到的现象是 ,说明反应放热。(下列装置中支撑及捆绑等仪器已略去)

乙方案:将盛放有生石灰的小试管插入带支管的试管中,支管接①或②,用胶头滴管向小试管中缓缓滴入水,看到的现象是(接①) ,(接②) ,说明反应放热。
丙方案:用胶头滴管向盛放有生石灰且带支管的试管中滴加水,支管接的导管中盛适量无水硫酸铜粉末,看到的现象是 ,说明反应放热,其原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物X是一种医药中间体,其结构简式如图所示。下列有关化合物X的说法正确的是( )
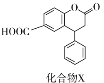
A. 分子中两个苯环一定处于同一平面
B. 不能与饱和Na2CO3溶液反应
C. 在酸性条件下水解,水解产物只有一种
D. 1mol化合物X最多能与1 molNaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常将铬镀在其他金属表面,同铁、镍组成各种性质的不锈钢,在下图装置中,观察到图1装置铜电极上产生大量的无色气泡,而图2装置中铜电极上无气体产生,铬电极上产生大量有色气体,则下列叙述正确的是( )
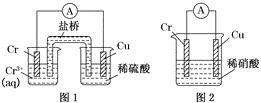
A. 图1为原电池装置,Cu电极上产生的是O2
B. 图2装置中Cu电极上发生的电极反应式为:Cu-2e-=Cu2+
C. 由实验现象可知:金属活动性Cu>Cr
D. 两个装置中,电子均由Cr电极流向Cu电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
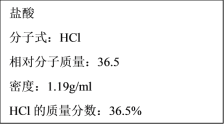
①该浓盐酸的物质的量浓度为___mol·L-1。
②某学生欲用上述浓盐酸和蒸馏水配制480ml物质的量浓度为0.4mol·L-1的稀盐酸,该学生需用量筒量取___mL上述浓盐酸进行配制,所需用的仪器除量筒、烧杯、胶头滴管和玻璃棒之外,还需要___。
(2)KClO3与浓盐酸在一定温度下反应会生成黄绿色的易爆物质二氧化氯,其变化可表述为:KClO3+HCl(浓)―KCl+ClO2↑+Cl2↑+
①请完成该化学方程式(将配平后的完整化学方程式写在答题卡上)___。
②浓盐酸在反应中显示出来的性质是__(填写编号)。
A.只有还原性 B.还原性和酸性 C.只有氧化性 D.氧化性和酸性
③若标况下产生了2.24LCl2,则生成ClO2的质量为__g。
④在KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O中,若标况下产生了6.72LCl2,则转移的电子数目为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要0.1mol·L-1NaOH溶液500mL。根据溶液的配制情况回答下列问题。
(1)在如图所示仪器中,配制上述溶液肯定不需要的是________(填字母),除图中已有仪器外,配制上述溶液还需要的玻璃仪器是________________________________________。
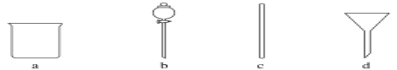
(2)配制时,正确的操作顺序是(用字母表示,每个操作只用一次)______________。
A.用少量水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡
B.在盛有NaOH固体的烧杯中加入适量水溶解
C.将烧杯中已冷却的溶液沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,反复上下颠倒,摇匀
E.改用胶头滴管加水,使溶液凹液面恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度线1~2cm处
(3)实验两次用到玻璃棒,其作用分别是:先用于___________、后用于____________。
(4) 根据计算用托盘天平称取NaOH固体的质量为________g。
(5)分析下列操作对所配制溶液浓度的影响(填“偏高”、“偏低”或“无影响”)。
①转移液体过程中有少量液体溅出:_______________。
②定容时仰视刻度线:_______。 ③容量瓶洗净后,未经干燥处理:________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com