
����Ŀ����1����ͼΪʵ����ijŨ�����Լ�ƿ��ǩ�ϵ��й����ݣ��Ը��ݱ�ǩ�ϵ��й����ݻش��������⣺
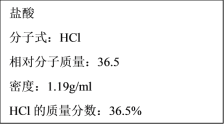
�ٸ�Ũ��������ʵ���Ũ��Ϊ___mol��L-1��
��ijѧ����������Ũ���������ˮ����480ml���ʵ���Ũ��Ϊ0.4mol��L-1��ϡ���ᣬ��ѧ��������Ͳ��ȡ___mL����Ũ����������ƣ������õ���������Ͳ���ձ�����ͷ�ιܺͲ�����֮�⣬����Ҫ___��
��2��KClO3��Ũ������һ���¶��·�Ӧ�����ɻ���ɫ���ױ����ʶ������ȣ���仯�ɱ���Ϊ��KClO3+HCl��Ũ���DKCl+ClO2��+Cl2��+
������ɸû�ѧ����ʽ������ƽ���������ѧ����ʽд�ڴ���ϣ�___��
��Ũ�����ڷ�Ӧ����ʾ������������__����д��ţ���
A.ֻ�л�ԭ�� B.��ԭ�Ժ����� C.ֻ�������� D.�����Ժ�����
��������²�����2.24LCl2��������ClO2������Ϊ__g��
����KClO3+6HCl(Ũ)=KCl+3Cl2��+3H2O�У�������²�����6.72LCl2����ת�Ƶĵ�����ĿΪ___��
���𰸡�11.9 16.8 500mL����ƿ 2KClO3+4HCl��Ũ��=2KCl+2ClO2��+Cl2��+2H2O B 13.5 0.5NA������3.01��1023��
��������
��1����c=![]() =
=![]() =11.9mol/L��
=11.9mol/L��
������480ml���ʵ���Ũ��Ϊ0.4mol��L-1��ϡ���ᣬӦѡ��500mL������ƿ������c1��V1= c2��V2��0.4mol��L-1��0.5L=11.9mol/L��V����V=16.8mL������ʵ�鲽�裬��Ҫ��������500mL����ƿ���ձ�����Ͳ������������ͷ�ιܣ�
��2���ٸ��ݼ�̬��ֻ��£���ཻ����ԭ��+5�۵�Cl��Ϊ+4�ۣ�-1�۵�Cl��Ϊ0�ۣ����õ�ʧ�����غ㣻
��Ũ�����ڷ�Ӧ��Cl�Ļ��ϼ����ߣ����ֻ�ԭ�ԣ�������ط�Ӧ�����κ�ˮ����������ԣ�
�۸���n(ClO2):n(Cl2)=2:1��m=nM���м��㣻
��KClO3�е�Cl�Ļ��ϼ���+5��Ϊ0�ۣ���5�����ӣ�����3��Cl2��
��1����c=![]() =
=![]() =11.9mol/L��
=11.9mol/L��
������480ml���ʵ���Ũ��Ϊ0.4mol��L-1��ϡ���ᣬӦѡ��500mL������ƿ������c1��V1= c2��V2��0.4mol��L-1��0.5L=11.9mol/L��V����V=16.8mL������ʵ�鲽�裬��Ҫ��������500mL����ƿ���ձ�����Ͳ������������ͷ�ιܣ�
��2���ٸ��ݼ�̬��ֻ��£���ཻ����ԭ��+5�۵�Cl��Ϊ+4�ۣ�-1�۵�Cl��Ϊ0�ۣ����õ�ʧ�����غ㣬��ʽΪ2KClO3+4HCl��Ũ��=2KCl+2ClO2��+Cl2��+2H2O��
��Ũ�����ڷ�Ӧ��Cl�Ļ��ϼ����ߣ����ֻ�ԭ�ԣ�������ط�Ӧ�����κ�ˮ����������ԣ���ΪB��
��n(ClO2):n(Cl2)=2:1������²�����2.24LCl2����0.1mol������������ClO2�����ʵ���Ϊ0.2mol����m=nM=0.2��67.5=13.5g��
��KClO3+6HCl(Ũ)=KCl+3Cl2��+3H2O�У�KClO3�е�Cl�Ļ��ϼ���+5��Ϊ0�ۣ���5�����ӣ�����3��Cl2��������²�����6.72LCl2����0.3molʱ��ת��0.5mol���ӣ���0.5NA��


 Сѧͬ�����������ܾ�ϵ�д�
Сѧͬ�����������ܾ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�2H2(g)+O2(g)![]() 2H2O(l)+566kJ������˵���������
2H2O(l)+566kJ������˵���������
A.H2![]() H+H�Ĺ�����Ҫ����
H+H�Ĺ�����Ҫ����
B.������2molˮ��������ų�����������566kJ
C.2g������ȫȼ������Һ̬ˮ���ͷŵ�����Ϊ283kJ
D.2mol������1mol����������֮�ʹ���2molҺ̬ˮ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ӵ�ʳ���Ǻ�KIO3��ʳ�Σ�����KIO3���ɷ�ӦKI+3Cl2+3H2O=KIO3+6HCl��ȡ�����������۵ļӵ�ʳ���еĵ�Ԫ�غ���Ϊ20��50mg/kg������㣺��ȡ1000kg����Ԫ��25.4mg/kg�ļӵ�ʳ�Σ���Ҫ����Cl2������Ƕ���___������״����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijһ��Ӧ��ϵ���з�Ӧ��������ﹲ5������:H2S+HNO3��S+NO+H2O;����˵������ȷ���ǣ� ��
A.�÷�Ӧ�еĻ�ԭ������S
B.����Ӧ������ת����0.3 mol ����,���������������9.6g
C.�������뻹ԭ�������ʵ���֮��Ϊ2��3
D.��Ӧ����Һ������������ǿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����CaSO4����O2��ȼ��CO��Ӧ���ȿ������ȼ��Ч�ʣ����ܵõ��ߴ�CO2����һ�ָ�Ч����ࡢ���õ�����ȼ�ռ�������Ӧ��Ϊ����Ӧ����Ӧ�ں͢�Ϊ����Ӧ��
��1/4CaSO4(s)+CO(g) ![]() 1/4CaS(s)+CO2(g) ��H1=��47.3kJ/mol
1/4CaS(s)+CO2(g) ��H1=��47.3kJ/mol
��CaSO4(s)+CO(g) ![]() CaO(s)+ CO2(g)+ SO2(g) ��H2=+210.5kJ/mol
CaO(s)+ CO2(g)+ SO2(g) ��H2=+210.5kJ/mol
��CO(g)![]() 1/2C(s)+1/2CO2(g) ��H3=-86.2kJ/mol
1/2C(s)+1/2CO2(g) ��H3=-86.2kJ/mol
��1����Ӧ2 CaSO4(s)+7CO(g) ![]() CaS(s)+CaO(s)+C(s)+6CO2(g)+SO2(g)�ġ�H=_______________���á�H1����H2�͡�H3��ʾ����
CaS(s)+CaO(s)+C(s)+6CO2(g)+SO2(g)�ġ�H=_______________���á�H1����H2�͡�H3��ʾ����
��2��Ϊ���ٸ������ø�������CO2�����ڳ�ʼȼ������������__________________��
��3���Է�Ӧ�������ɵ�CaSΪԭ�ϣ���һ�������¾�ԭ��������100%�ĸ��·�Ӧ����������CaSO4���÷�Ӧ�Ļ�ѧ����ʽΪ___________����һ��������CO2����Զ��ױ���Ӧ�����䱽��������һ���Ȼ�������Ľṹ��ʽΪ_______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��ȷ����(����)
A.̼��������Һ������ʯ��ˮ��ӦHCO3��+Ca2++OH����CaCO3��+H2O
B.�Ȼ����������������Ũ��Һ��ϼ���OH��+NH4+![]() H2O+NH3��
H2O+NH3��
C.����������ϡ���ᷴӦH++OH����H2O
D.����ͭ��ϡ���ᷴӦCu+2H++2NO3����Cu2++2NO��+H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������11.2 g KOH��ϡ��Һ��1 L 0.1 molL��1��H2SO4��Һ��Ӧ���ų�11.46 kJ�������������Ȼ�ѧ����ʽ��ȷ����
A. KOH(aq)��![]() H2SO4(aq) ===
H2SO4(aq) === ![]() K2SO4(aq)��H2O(l) ��H ����11.46 kJmol��1
K2SO4(aq)��H2O(l) ��H ����11.46 kJmol��1
B. 2KOH(aq)��H2SO4(aq) === K2SO4(aq)��2H2O(l) ��H ����11.46 kJmol��1
C. 2KOH(aq)��H2SO4(aq) === K2SO4(aq)��2H2O(l) ��H ��+114.6 kJmol��1
D. KOH(aq)��![]() H2SO4(aq) ===
H2SO4(aq) === ![]() K2SO4(aq)��H2O(l) ��H ����57.3 kJmol��1
K2SO4(aq)��H2O(l) ��H ����57.3 kJmol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ���ҳ���Na2O2��H2O��Ӧ������ȡ����O2��������װ����ȡO2����ʾNa��O2�е�ȼ��ʵ�飮
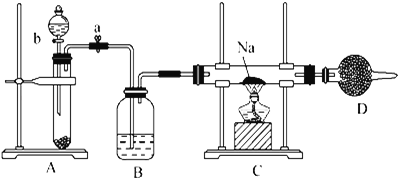
��ش��������⣺
(1)д��Aװ���з�Ӧ�Ļ�ѧ����ʽ_____��
(2)Bװ����ʢ�ŵ��Լ���_____��
(3)Dװ����ʢ�ŵ��Լ���_____����������_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���縡ѡ���۷��ǹ�ҵ�ϲ��õ�һ����ˮ������������������ˮ��pH��5.0��6.0֮�䣬ͨ���������Fe(OH)3���壬Fe(OH)3��������������ã�������ˮ�е������ʹ�������������ˮ�����ã���ԭ����ͼ��ʾ������˵����ȷ����

A. ʯī�缫�Ϸ���������Ӧ
B. ����ͼʾ������AΪCO2
C. Ϊ��ǿ��ˮ�ĵ���������������ˮ�м��������Ҵ�
D. ����ȼ�ϵ����CO32�������һ���ƶ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com