
【题目】根据相应的图像,判断下列相关说法错误的是
A.图①中,密闭容器中反应达到平衡,t0时改变某一条件,则改变的条件可能是加压(a+b=c)或使用催化剂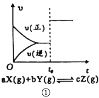
B.图②是达到平衡时外界条件对平衡的影响关系,则正反应为放热反应,p2>p1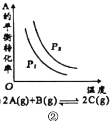
C.图③是物质的百分含量和温度T关系,则反应为放热反应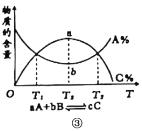
D.图④是反应速率和反应条件变化关系,则该反应的正反应为吸热反应,且A、B、C、D一定均为气体
【答案】D
【解析】
A.若a+b=c,则可逆反应为气体体积不变的反应,由题给信息可知,平衡后改变条件,正逆反应速率都增大且始终相等,且平衡不移动,说明改变的条件可能是加压或使用催化剂,A项正确;
B.由图可知,压强一定时,随着温度的升高,A的平衡转化率逐渐减小,说明反应为放热反应;分析题中可逆反应方程式,可知可逆反应为气体体积减小的反应,在保持温度不变时,p2条件下A的平衡转化率大于p1条件下A的平衡转化率,说明p2>p1,B项正确;
C.由图中T2~T3可知。平衡后升高温度,反应逆向移动,则该反应的正反应为放热反应,C项正确;
D.由图可知,反应达第一次平衡时,减小压强,正逆反应速率均减小且正反应速率大于逆反应速率,反应正向移动,说明生成物中气体的化学计量数之和大于反应物中气体的化学计量数之和,则A、B、C、D不一定均为气体;可逆反应达第二次平衡时,升高温度,正逆反应速率都增大且正反应速率大于逆反应速率,反应正向移动,说明该可逆反应的正反应为吸热反应,D项错误;
答案选D。


科目:高中化学 来源: 题型:
【题目】在浓CaCl2溶液中通入NH3和CO2,可以制得纳米级碳酸钙(粒子直径在1~100nm之间)。如图所示A~E为实验室常见的仪器装置(部分固定夹持装置略去),请根据要求回答问题。
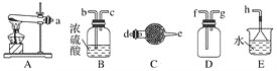
(1)实验室制取、收集干燥的NH3,需选用上述仪器装置的接口连接顺序是(选填字母):a接__、___接__,__接h;实验室用A装置制取NH3的化学方程式为___。
(2)向浓CaCl2溶液中通入NH3和CO2气体制纳米级碳酸钙时,应先通入的气体是___,试写出制纳米级碳酸钙的化学方程式:___。
(3)试设计简单的实验方案,判断所得碳酸钙样品颗粒是否为纳米级:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A.用含0.1molFeCl3的饱和溶液制取Fe(OH)3胶体得0.1NA个胶粒
B.将含有NA个Al3+的AlCl3溶液完全蒸干,可得到1mol的固体AlCl3
C.电解法精炼铜,当电路中有0.2NA个电子转移时,阳极的质量一定减轻6.4g
D.25℃时,pH=13的1.0LBa(OH)2溶液中含有的OH-数目约为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某铝合金(硬铝)中含有镁、铜、硅,为了测定该合金中铝的含量,有人设计如下实验:
(1)称取样品ag。
(2)将样品溶于足量稀盐酸中,过滤,滤液中主要含有___离子,滤渣中含有___;在溶解过滤时使用的仪器有___。
(3)往滤液中加入过量NaOH溶液,过滤,写出该步操作中有关的离子方程式____。
(4)在第(3)步的滤液中通入足量CO2过滤,将沉淀用蒸馏水洗涤数次后,烘干并灼烧至质量不再减少为止,冷却后称量,质量为bg。有关反应的化学方程式为____。
(5)计算该样品中铝的质量分数的表达式为___。
(6)若第(3)步中加入NaOH溶液的量不足时,会使测定的结果___(“偏高”“偏低”或“无影响”,下同)。若第(4)步对沉淀的灼烧不充分时,会使测定的结果___。若第(4)步中的沉淀没有用蒸馏水洗涤时,会使测定的结果____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏伽德罗常数的数值,下列说法不正确的是
A.500mL 0.1mol/L的Na2SO4溶液中含Na+数目为0.1NA
B.标准状况下,11.2L H2O含有氧原子大于0.5NA
C.常温常压下,32 g氧气(O2)和臭氧(O3)的混合气体中含有的氧原子数为2NA
D.标准状况下,2.24 L N2和O2的混合气体中原子数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应在日常生活中有着广泛的应用,下列有关化学用语和相关说法均正确的是
选项 | 化学反应方程式 | 相关说法 |
A |
| 氧气是氧化产物,氯酸钾既是氧化剂又是还原剂 |
B | Cl2+2Br-=2Cl-+Br2 Zn+Cu2+=Zn2++Cu | 均为单质被还原的置换反应 |
C | 4CuO | 该反应中每生成1molO2,则转移2NA个电子 |
D | 2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑ | 氧化性:Na2O2>Na2FeO4>FeSO4 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“84消毒液”因1984年北京某医院研制使用而得名,在2020年抗击新型冠状病毒肺炎中被广泛用于消毒,其有效成分是NaClO。某校化学研究性学习小组在实验室制备NaClO溶液,并进行性质探究和成分测定。
已知:①室温下,饱和NaClO溶液pH为11
②25℃时,H2CO3:Ka1=4.4×10-7,Ka2=4.7×10-11;HClO:Ka=3.0×10-8
I.制备NaClO溶液
该学习小组按下图装置进行实验(部分夹持装置省去)
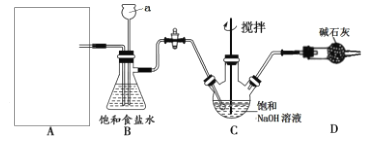
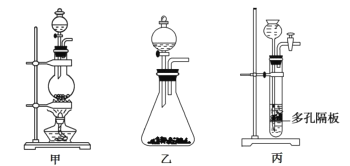
(1)上图中A为实验室制备Cl2的发生装置,可以选用下列图中_(填代号)装置,用该装置制备Cl2反应的化学方程式为__。
(2)B装置中仪器a的名称是____,B装置可除去氯气中氯化氢杂质, 此外还有______作用(写出一点)。
II.NaClO性质探究
按上图装置进行实验,一段时间后,取C瓶中的溶液进行实验,如下表:
实验内容 | 实验现象 | |
实验l | 取样,滴加紫色石蕊试液 | 变蓝,不褪色 |
实验2 | 测定溶液的pH | 12 |
(3)C瓶溶液中的溶质除NaCl外,还有______(填化学式)。
(4)将C瓶中NaOH溶液换成NaHCO3溶液,反应一段时间后,取C瓶中的溶液按上表实验内容进行实验。现象为:实验l中紫色石蕊试液立即褪色,实验2中溶液的pH=7。结合平衡移动原理解释紫色石蕊试液立即褪色的原因是________。
III.测定C瓶溶液中NaClO含量(单位:g·L-1)
i.取C瓶溶液10.00mL于锥形瓶中,加入适量硫酸酸化,迅速加入过量KI溶液,盖紧瓶塞并在暗处充分反应。
ii.用0.1000molL-1Na2S2O3标准溶液滴定上述锥形瓶中的溶液至终点,重复操作2~3次,消耗Na2S2O3溶液的平均用量为12.00mL。(已知:I2+2![]() =2I-+
=2I-+![]() )
)
(5)i中主要发生反应的离子方程式为_______,ii中用_______作指示剂。
(6)盖紧瓶塞并在暗处反应的原因是________。
(7)C瓶溶液中NaClO含量是______g·L-1(保留2位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pc类似pH,是指极稀溶液中溶质物质的量浓度的常用对数负值。如某溶液溶质的浓度为1×10-3mol/L,则该溶液溶质的pc=3。下列说法正确的是
A.25°C时,0.01mol/LNa2S水溶液中,pc(H+)+pc(OH-)=14
B.用0.01mol/L的NaOH溶液滴定某浓度的盐酸,滴定过程中pc(OH-)逐渐增大
C.某温度下,弱酸HB的Ka=1×10-5mol/L,则该溶液中pc(H+)+pc(B-)=l0
D.向0.0lmol/L的Ca(HCO3)2溶液中逐渐滴加烧碱溶液,滴加过程中pc(Ca2+)逐渐减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一同学设计了两种由CuO→Cu的实验方案:
方案一:Zn![]() H2
H2![]() Cu;
Cu;
方案二:CuO![]() CuSO4
CuSO4![]() Cu。
Cu。
大家认为方案二优于方案一,理由是:①节约能源;②Cu产率高;③产品纯净;④操作安全。其中,评价正确的是( )
A.①②③B.①②④C.①③④D.②③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com