
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A.用含0.1molFeCl3的饱和溶液制取Fe(OH)3胶体得0.1NA个胶粒
B.将含有NA个Al3+的AlCl3溶液完全蒸干,可得到1mol的固体AlCl3
C.电解法精炼铜,当电路中有0.2NA个电子转移时,阳极的质量一定减轻6.4g
D.25℃时,pH=13的1.0LBa(OH)2溶液中含有的OH-数目约为0.1NA
 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案科目:高中化学 来源: 题型:
【题目】蓝矾(CuSO4·5H2O)常作杀菌剂。某小组设计如图1装置制备蓝矾,实验原理: Cu+CuCl2=2CuCl,4CuCl+O2+2H2O=2[Cu(OH)2·CuCl2],[Cu(OH)2·CuCl2]+H2SO4=CuSO4+CuCl2+2H2O。
操作步骤:向三颈瓶加入3.2 g Cu粉和适量稀硫酸及30 mL 1 mol·L-1 CuCl2溶液,利用二连球向三颈瓶中鼓入空气,铜溶解。当三颈烧瓶中呈乳状浑浊液时,滴加浓硫酸,得到蓝矾(不考虑氯化铜转化成硫酸铜)。下列说法正确的是

A.盛装CuCl2溶液的仪器是长颈漏斗B.在实验过程中,浓硫酸作氧化剂
C.采用重结晶法提纯CuSO4·5H2OD.理论上可以制备20 g CuSO4·5H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016 年诺贝尔化学奖授予在“分子机器设计和合成”领域有突出成就的三位科学家,其研究对象之一“分子开关”即与大环主体分子苯芳烃、硫或氮杂环杯芳烃等有关。回答下列问题:
(1)对叔丁基杯[4]芳烃(如图Ⅰ所示)可用于ⅢB 族元素对应离子的萃取,如La3+、Sc2+。写出基态二价 钪离子(Sc2+)的核外电子排布式:____,其中电子占据的轨道数为_____个。
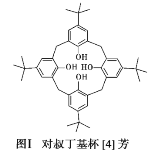
(2)对叔丁基杯[4]芳烃由4个羟基构成杯底,其中羟基氧原子的杂化方式为_____,羟基间的相互作用力为_____。
(3)不同大小苯芳烃能识别某些离子,如:N3-、SCN等。一定条件下,SCN与 MnO2反应可得到(SCN)2,试写出(SCN)2的结构式_______。
(4)NH3分子在独立存在时 H-N-H 键角为 106.7°。 [Zn(NH3)6]2+离子中 H-N-H 键角变为 109.5°,其原因是:_________________________。
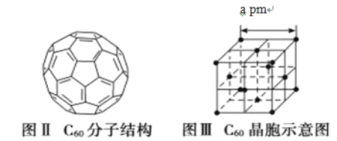
(5)已知 C60 分子结构和 C60 晶胞示意图(如图Ⅱ、图Ⅲ所示):则一个 C60 分子中含有σ键的个数为______,C60 晶体密度的计算式为____gcm3。(NA 为阿伏伽德罗常数 的值)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化合物G是4-羟基香豆素,是重要的医药中间体,可用来制备抗凝血药,可通过下列路线合成。
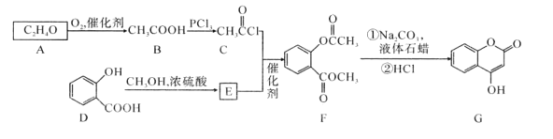
请回答:
(1)D→E的反应类型是___。
(2)G中含有的官能团名称为____。
(3)写出G和过量NaOH溶液共热时反应的化学方程式___。
(4)化合物E的同分异构体很多,符合下列条件的结构共___种。
①能与氯化铁溶液发生显色反应;②能发生银镜反应;③能发生水解反应
其中,核磁共振氢谱为5组峰,且峰面积比为2:2:2:1:1的结构简式为____。
(5)E的同分异构体很多,所有同分异构体在下列某种表征仪器中显示的信号(或数据)完全相同,该仪器是___(填标号)。
a.质谱仪 b.元素分析仪 c.红外光谱仪 d.核磁共振仪
(6)已知酚羟基一般不易直接与羧酸酯化。苯甲酸苯酚酯(![]() )是一种重要的有机合成中间体。请根据已有知识并结合相关信息,试写出以苯酚、甲苯为原料制取该化合物的合成路线流程图(无机原料任选):___。
)是一种重要的有机合成中间体。请根据已有知识并结合相关信息,试写出以苯酚、甲苯为原料制取该化合物的合成路线流程图(无机原料任选):___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组用下列装置完成了探究浓硫酸和 SO2性质的实验(部分夹持装置已省略),下列“ 现象预测” 与“ 解释或结论” 均正确的是
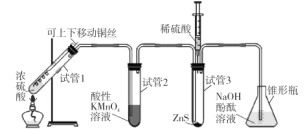
选项 | 仪器 | 现象预测 | 解释或结论 |
A | 试管1 | 有气泡、酸雾,溶液中有白色固体出现 | 酸雾是SO2所形成,白色固体是硫酸铜晶体 |
B | 试管2 | 紫红色溶液由深变浅,直至褪色 | SO2具有还原性 |
C | 试管3 | 注入稀硫酸后,没有现象 | 由于Ksp(ZnS)太小,SO2与ZnS在注入稀硫酸后仍不反应 |
D | 锥形瓶 | 溶液红色变浅 | NaOH溶液完全转化为NaHSO3溶液,NaHSO3溶液碱性小于NaOH |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可以证明可逆反应N2+3H2![]() 2NH3已达到平衡状态的是
2NH3已达到平衡状态的是
①一个N≡N断裂的同时,有3个H—H键断裂
②一个N≡N键断裂的同时,有6个N—H键断裂
③其它条件不变时,混合气体平均相对分子质量不再改变
④恒温恒容时,体系压强不再改变
⑤NH3、N2、H2的体积分数都不再改变
⑥恒温恒容时,混合气体的密度保持不变
⑦正反应速率v(H2)=0.6mol/(L·min),逆反应速率v(NH3)=0.4mol/(L·min)
A.全部B.①③④⑤C.②③④⑤⑦D.③⑤⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:pAg=![]() lg[c(Ag+)],Ksp(AgCl)=1×10-12。如图是向10mLAgNO3溶液中逐渐加入0.1mol·L-1的NaCl溶液时,溶液的pAg随着加入NaCl溶液的体积(单位:mL)变化的图像(实线)。根据图像所得下列结论不正确的是[提示:Ksp(AgCl)>Ksp(AgI)]
lg[c(Ag+)],Ksp(AgCl)=1×10-12。如图是向10mLAgNO3溶液中逐渐加入0.1mol·L-1的NaCl溶液时,溶液的pAg随着加入NaCl溶液的体积(单位:mL)变化的图像(实线)。根据图像所得下列结论不正确的是[提示:Ksp(AgCl)>Ksp(AgI)]
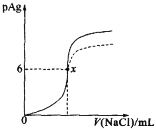
A.原AgNO3溶液的物质的量浓度为1mol·L-1
B.图中x点的坐标为(100,6)
C.图中x点可认为溶液中Ag+被沉淀完全
D.把0.1mol·L-1的NaCl换成0.1mol·L-1NaI,则图像在终点后变为虚线部分
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据相应的图像,判断下列相关说法错误的是
A.图①中,密闭容器中反应达到平衡,t0时改变某一条件,则改变的条件可能是加压(a+b=c)或使用催化剂
B.图②是达到平衡时外界条件对平衡的影响关系,则正反应为放热反应,p2>p1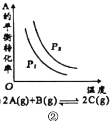
C.图③是物质的百分含量和温度T关系,则反应为放热反应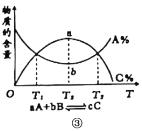
D.图④是反应速率和反应条件变化关系,则该反应的正反应为吸热反应,且A、B、C、D一定均为气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上电解NaHSO4溶液制备Na2S2O8(过二硫酸钠)。电解时,阴极材料为Pb;阳极(铂电极)电极反应式为2![]() -2e-=
-2e-=![]() +2H+。下列说法正确的是
+2H+。下列说法正确的是
A.Na2S2O8水溶液呈弱碱性
B.Na2S2O8可水解生成H2O2,同时生成NaHSO4可循环利用
C.H2S2O8可完全电离,故稳定性与硫酸相当
D.Na2S2O8具有强氧化性,故不能使酸性高锰酸钾溶液褪色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com