
【题目】海洋植物如海带海藻中含有丰富的碘元素,实验室里从海藻中提取碘的流程如图:
 请回答:
请回答:
(1)写出提取过程中有关实验操作的名称:①____、③___。
(2)操作③用到的主要玻璃仪器____。
(3)提取碘的过程中,可加入的有机溶剂是___,用力振荡、静置后,上层呈___色,下层呈____色。
(4)写出②的离子方程式_____。
(5)工业提取得到的碘可用于制药品——华素片(西地碘片),其活性成分为分子碘。请你设计一种方法来验证华素片中的分子碘,其方法是(用文字描述):__。
【答案】过滤 萃取分液 分液漏斗和烧杯 苯(或CCl4) 紫红(或无) 无(或紫红) Cl2+ 2I-=I2+2Cl- 取一粒药片在研钵中研碎,再将药粉装入试管中并加入约2mL蒸馏水;充分溶解后,再向试管中再加入约2mL CCl4,充分震荡后静置,观察试管下层呈紫红色,说明含有碘单质。(方法正确即可,如:取一粒华素片研细,先溶于水配成溶液,再滴加淀粉溶液,若溶液变蓝,说明华素片含碘单质。)
【解析】
将海藻在坩埚中煅烧,得到海藻灰,使用蒸馏水溶解浸泡形成悬浊液,过滤后得到含有碘离子的溶液,向滤液中通入氯气将碘离子氧化为碘单质,转变为含有碘单质的溶液,再向溶液中加入有机溶剂萃取碘,将碘转移到有机溶剂中后进行分液,对含有碘的有机溶剂进行蒸馏操作,最后得到碘单质。
(1)根据上述分析,操作①为过滤,操作③为萃取分液;
答案为:过滤;萃取分液;
(2)萃取分液使用的主要玻璃仪器为分液漏斗和烧杯;
答案为:分液漏斗和烧杯;
(3)苯或CCl4,使用苯做萃取剂时,苯的密度小于水,苯在上层呈紫红色,下层为无色水溶液;若用CCl4做萃取剂时,CCl4的密度大于水,上层为无色水溶液,CCl4在下层呈紫红色;
答案为:苯;紫红;无;(或CCl4;无;紫红)
(4)②为氯气将碘离子氧化变为碘单质,反应方程式为Cl2+ 2I-=I2+2Cl-;
答案为:Cl2+ 2I-=I2+2Cl-;
(5)取一粒药片在研钵中研碎,再将药粉装入试管中并加入约2mL蒸馏水;充分溶解后,再向试管中再加入约2mL CCl4,充分震荡后静置,观察试管下层呈紫红色,即可证明华素片中含有分子碘;
答案为:取一粒药片在研钵中研碎,再将药粉装入试管中并加入约2mL蒸馏水;充分溶解后,再向试管中再加入约2mL CCl4,充分震荡后静置,观察试管下层呈紫红色,说明含有碘单质。(方法正确即可,如:取一粒华素片研细,先溶于水配成溶液,再滴加淀粉溶液,若溶液变蓝,说明华素片含碘单质。)


科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 18.0 g葡萄糖和果糖的混合物中含有氢原子的数目为1.2 NA
B. 0.1 mol MgCl2中含有最外层电子的数目为1.6NA
C. 1 L 0.1 mol/L乙醇溶液中含有氧原子的数目为0.1 NA
D. 0.1 mol Fe与足量Cl2完全反应转移电子的数目为0.2 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮肥是最重要的化肥,它能使农作物枝叶茂盛,叶片增大,促进叶绿素的形成,从而有利于光合作用,提高农作物产量和质量。
(1)氮气分子的电子式是_________,氨气分子的空间形状为:__________。
(2)农谚有“雷雨发庄稼”一说。用化学方程式表示在闪电作用下游离态氮转化为化合态氮的过程_____.
(3)合成氨工业是氮肥的最主要来源。写出工业合成氨的化学方程式 _________________.
(4)合成氨工业也是硝酸工业的基础,写出氨催化氧化的化学方程式_____________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三盐基硫酸铅(3PbO·PbSO4·H2O,其相对分子质量为990)简称“三盐”,不溶于水及有机溶剂。主要适用于不透明的聚氯乙烯硬质管、注射成型制品,也可用于人造革等软质制品。以铅泥 (主要成分为PbO、Pb及PbSO4等)为原料制备三盐的工艺流程如下图所示。


已知:KSP(PbSO4)=1.82×10-8,KSP(PbCO3)=1.46×10-13请回答下列问题:
(1)写出步骤①“转化”的离子方程式__________________。
(2)根据右图溶解度曲线(g/100g水),由滤液I得到Na2SO4固体的操作为:将“滤液1”、_________、_________、用乙醇洗涤后干燥。
(3)步骤③“酸溶”,为提高酸溶速率,可采取的措施是________________(任意写出一条)
(4)“滤液2”中可循环利用的溶质为_______(填化学式)。若步骤④“沉铅”后的滤液中c(Pb2+)=1.82×10-5 mol·L-1,则此时c(SO42-)=________mol·L-1。
(5)步骤⑥“合成”三盐的化学方程式为____________________。
(6)若消耗100.0t铅泥,最终得到纯净干燥的三盐49.5t,假设铅泥中的铅元素有75%转化为三盐,则铅泥中铅元素的质量分数为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四种元素核电荷数均小于18。A元素原子核内无中子,B元素的原子L层电子数是K层电子数的3倍,C元素原子的M层电子数比K层电子数多1个,D2-离子比C3+离子多一个电子层。请回答:
(1)写出元素名称:A___、B___、C___、D___。
(2)画处C3+离子结构示意图_____。
(3)画出D2-离子的电子式_____。
(4)写出B、C形成的化合物的化学式____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里用乙醇和浓硫酸反应制取乙烯,接着再用溴与之反应生成1,2—二溴乙烷。在制备过程中由于部分乙醇被浓硫酸氧化还会生成CO2、SO2,进而与Br2反应生成HBr等。
(1)以上述三种物质为原料,用下列仪器(短接口或橡皮管均已略去)制备1,2-二溴乙烷。
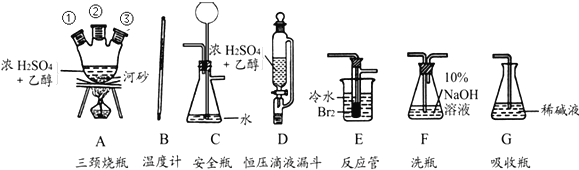
如果气体流向为从左到右,正确的连接顺序是:B经A①插入A中,D接A②;A③接______接_______接______接______。
(2)温度计水银球的正确位置是______。
(3)F的作用是______,G的作用是______。
(4)在三颈烧瓶A中的主要反应的化学方程式为______。
(5)在反应管E中进行的主要反应的化学方程式为______。
(6)反应管E中加入少量水及把反应管E置于盛有冷水的小烧杯中是因为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)溶质的质量分数为14%的KOH溶液,经加热蒸发去100g水后,质量分数变成28%,体积为80mL,则此时溶液的物质的量浓度为
A. 5mol/L B. 6mol/L C. 6.25mol/L D. 6.75mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是利用一种微生物将废水中的有机物(如淀粉)和废气NO的化学能直接转化为电能,下列说法中一定正确的是

A. 质子透过阳离子交换膜由右向左移动
B. 电子流动方向为N→Y→X→M
C. M电极反应式:(C6H10O5)n+7nH2O-24ne-===6nCO2↑+24nH+
D. 当M电极微生物将废水中16.2 g淀粉转化掉时,N电极产生134.4 L N2(标况下)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com